
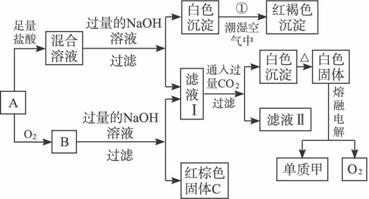
(1)单质乙的化学式为_________________________________________________。
(2)单质甲与红棕色固体在高温下反应的化学方程式_______________________________。
(3)反应①的化学方程式_________________________________________________。
(4)若向滤液Ⅰ中加入过量的盐酸,写出有关反应的离子方程式_____________________。
(5)向20 mL浓度为1 mol/L的甲的氯化物水溶液中加入1 mol/L的NaOH溶液,生成沉淀
(1)Fe
(2)2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
(3)4Fe(OH)2+O2+2H2O====4Fe(OH)3
(4)![]() +4H+====Al3++2H2O
+4H+====Al3++2H2O
(5)30 mL、70 mL
解:红褐色沉淀为Fe(OH)3,由反应①知白色沉淀为Fe(OH)2,说明A中有单质Fe,A与O2反应有两种氧化物,但加入NaOH溶液后只得红棕色固体C(Fe2O3),那么,另一种氧化物能与NaOH溶液反应,易知为Al2O3,则A中有单质Al,Ⅰ为NaAlO2,向NaAlO2溶液中通入过量CO2生成Al(OH)3沉淀和NaHCO3,即Ⅱ为NaHCO3。由2Al2O3(熔融)![]() 4Al+3O2↑知甲为Al,乙为Fe。Al与Fe2O3反应为铝热反应,即Fe2O3+2Al
4Al+3O2↑知甲为Al,乙为Fe。Al与Fe2O3反应为铝热反应,即Fe2O3+2Al![]() Al2O3 +2Fe。对第(5)问,若NaOH少量,Al3+过量,由关系式3OH-—Al(OH)3↓知V(NaOH)=30 mL;若NaOH的量较多,Al3+完全反应,则反应有Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-====
Al2O3 +2Fe。对第(5)问,若NaOH少量,Al3+过量,由关系式3OH-—Al(OH)3↓知V(NaOH)=30 mL;若NaOH的量较多,Al3+完全反应,则反应有Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-====![]() +2H2O(生成的沉淀部分溶解,剩余
+2H2O(生成的沉淀部分溶解,剩余


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
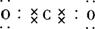
请填写以下空白:
(1)写出C的电子式________________。
(2)写出反应①的化学方程式________________。
反应②的离子方程式________________。
(3)甲和乙的化学式分别为________________、________________,若A中组成元素的物质的量之比为4:9,则乙在A中的物质的量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体,N为红褐色固体。(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出)
请填写以下空白:
(1)写出C的电子式______________。
(2)写出反应①的化学方程式______________。
反应②的离子方程式_________________。
(3)甲和乙的化学式分别为________、________,
若A中组成元素的物质的量之比为4∶9,则乙在A中的物质的量分数为________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com