
 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
| ||
| 冰晶石 |
| ||
| 冰晶石 |
| 1 |
| 8 |
| 1 |
| 2 |
| 78g |
| NA |
| m |
| ρ |
| 4×78g/mol |
| ag/cm3×6.02×1023mol-1 |
| 4×78g/mol |
| ag/cm3×6.02×1023mol-1 |


科目:高中化学 来源: 题型:
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| 第一组 | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| 第二组 | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| 第三组 | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| 第四组 | CO2(CO) | 氧气 | 点燃 |
| A、第一组 | B、第二组 |
| C、第三组 | D、第四组 |
查看答案和解析>>
科目:高中化学 来源: 题型:
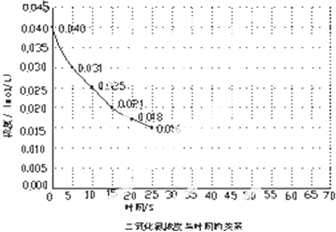
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
14 7 |
15 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝是一种电解质,可用于电解法制铝 |
| B、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com