
| m |
| M |
| 54g |
| 135g/mol |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
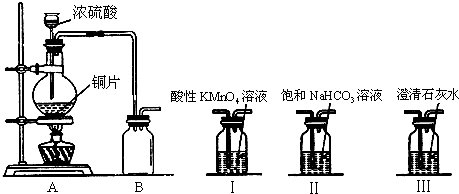
查看答案和解析>>
科目:高中化学 来源: 题型:
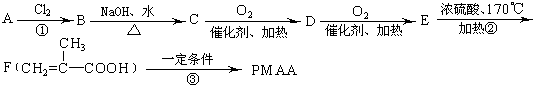
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
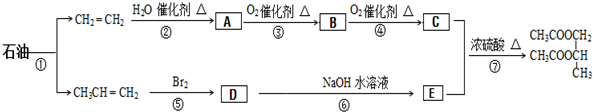
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
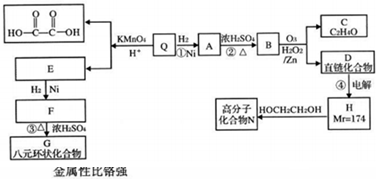
| KMnO4/H+ |
| O3 |
| H2O2/Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
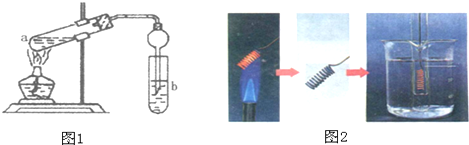
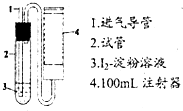 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com