
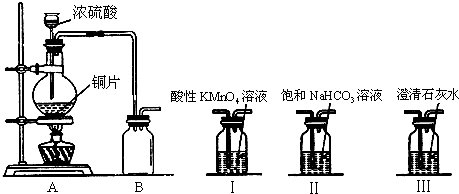
| ||
| ||


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
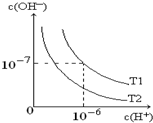 如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+H2SO4═FeSO4+H2↑ | ||||
B、CO+CuO
| ||||
C、Cu2(OH)2CO3
| ||||
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
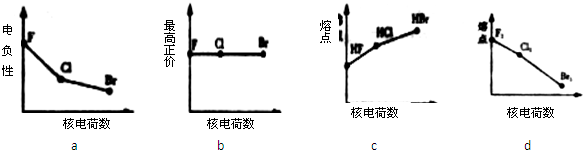
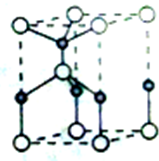 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为查看答案和解析>>
科目:高中化学 来源: 题型:
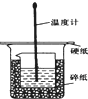 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲、乙两溶液均呈酸性 |
| B、甲、乙两溶液中c(H+)之比为1:2 |
| C、甲、乙两溶液中水的电离程度大小无法比较 |
| D、甲中水的电离程度小于乙中水的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com