
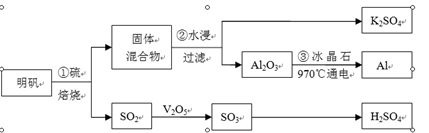
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
 (2分)
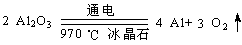
(2分) CO2或2C+O2
CO2或2C+O2 2CO ,条件用加热或970℃也可)
2CO ,条件用加热或970℃也可)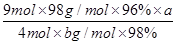 或
或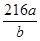 (3分,不带单位不扣分,化简也可以)
(3分,不带单位不扣分,化简也可以) ;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。 。
。

科目:高中化学 来源:不详 题型:单选题
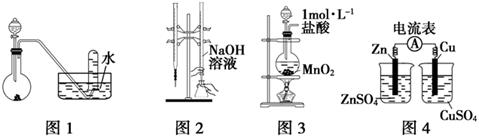
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置检验电流的方向 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
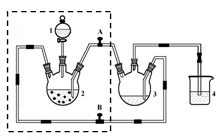
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
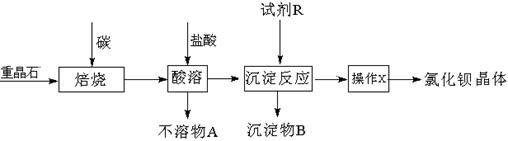
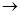
 ……
…… ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
 +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
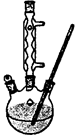

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 编号 | V (Na2CO3)/mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
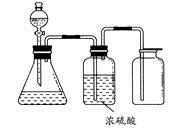
| A.铜屑和稀硝酸 |
| B.二氧化锰和浓盐酸 |
| C.用浓氨水和生石灰反应 |
| D.碳酸钙和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com