
【题目】甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①写出制取氯气的化学方程式______________。
②该装置的不足之处除无尾气吸收装置外,另一处是______________。
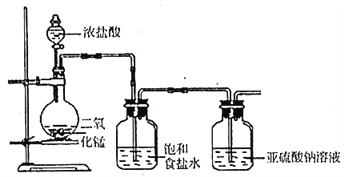
③Cl2与Na2SO3溶液反应的离子方程式为____________。
④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化_________。
(2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四只大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
实验试剂 | 试管I | 试管II | 试管Ⅲ | 试管IV |
乙酸乙酯/mL | 1 | V1 | V2 | V3 |
1mol/LNaOH/mL | V4 | 3 | 0 | V5 |
蒸馏水/mL | 0 | V6 | 5 | 2 |
⑤请完成上表,其中V2=______,V4=______,V5=_______。
⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是____;实验中,试管IV比试管II中的酯层减少更快,其原因有:温度高速率快,还可能有_________。 (乙酸乙酯沸点为77.1℃)
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 没有加热装置 Cl2+SO32-+H2O=2Cl-+SO42-+2H+ 取少量洗气瓶中的液体于干燥试管中,加入足量盐酸(滴加稀盐酸至不再产生气体),再滴加少量的氯化钡溶液,若产生白色沉淀,则证明已经被氧化 V2=1 V4=5 V5=3 碳酸钠溶液水解显碱性,干扰了探究NaOH溶液对水解速率的影响 水浴加热接近乙酸乙酯的沸点,温度越高,乙酸乙酯挥发也越快,得不到正确结果
MnCl2+Cl2↑+2H2O 没有加热装置 Cl2+SO32-+H2O=2Cl-+SO42-+2H+ 取少量洗气瓶中的液体于干燥试管中,加入足量盐酸(滴加稀盐酸至不再产生气体),再滴加少量的氯化钡溶液,若产生白色沉淀,则证明已经被氧化 V2=1 V4=5 V5=3 碳酸钠溶液水解显碱性,干扰了探究NaOH溶液对水解速率的影响 水浴加热接近乙酸乙酯的沸点,温度越高,乙酸乙酯挥发也越快,得不到正确结果
【解析】(1)①实验室利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,制取氯气的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;②浓盐酸与二氧化锰制取氯气的反应需要加热,氯气有毒,应该使用尾气吸收装置,故答案为:没有加热装置;③氯气与亚硫酸钠溶液反应生成硫酸钠和氯化氢,反应的离子方程式为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;④若洗气瓶中的Na2SO3已被氧化,则洗气瓶的溶液中应该存在硫酸根离子,检验方法为:取少量洗气瓶中的液体于干燥试管中,加入足量盐酸(滴加稀盐酸至不再产生气体),再滴加少量的氯化钡溶液,若产生白色沉淀,则证明已经被氧化;(2)⑤乙组探究乙酸乙酯(沸点77.1℃)在不同温度、不同浓度NaOH溶液中的水解速率,四个试管中乙酸乙酯的体积都应该为1mL,即:V1=V2=V3=1;试验Ⅰ和试验Ⅲ中蒸馏水的体积不同,则探究的是氢氧化钠的浓度对乙酸乙酯水解的影响,还必须保证溶液总体积相等,则氢氧化钠溶液体积应该为5mL,即:V4=5;试管Ⅳ与试管Ⅰ、Ⅱ、Ⅲ的反应温度不同,说明是探究温度对乙酸乙酯的水解影响,结合总体积必须相等可知,试管Ⅳ和试管Ⅱ应该是探究温度对乙酸乙酯水解程度影响大小的,故氢氧化钠溶液体积应该为3mL,即:V5=3,即:V2=1,V4=5,V5=3;⑥碳酸钠溶液水解显碱性,干扰了探究NaOH溶液对水解速率的影响,所以不能用饱和Na2CO3溶液替代蒸馏水;乙酸乙酯的沸点为77.1℃,水浴温度接近乙酸乙酯的沸点,温度越高,乙酸乙酯挥发也越快,导致试管中酯层减少速率加快,干扰了实验结果。
MnCl2+Cl2↑+2H2O;②浓盐酸与二氧化锰制取氯气的反应需要加热,氯气有毒,应该使用尾气吸收装置,故答案为:没有加热装置;③氯气与亚硫酸钠溶液反应生成硫酸钠和氯化氢,反应的离子方程式为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;④若洗气瓶中的Na2SO3已被氧化,则洗气瓶的溶液中应该存在硫酸根离子,检验方法为:取少量洗气瓶中的液体于干燥试管中,加入足量盐酸(滴加稀盐酸至不再产生气体),再滴加少量的氯化钡溶液,若产生白色沉淀,则证明已经被氧化;(2)⑤乙组探究乙酸乙酯(沸点77.1℃)在不同温度、不同浓度NaOH溶液中的水解速率,四个试管中乙酸乙酯的体积都应该为1mL,即:V1=V2=V3=1;试验Ⅰ和试验Ⅲ中蒸馏水的体积不同,则探究的是氢氧化钠的浓度对乙酸乙酯水解的影响,还必须保证溶液总体积相等,则氢氧化钠溶液体积应该为5mL,即:V4=5;试管Ⅳ与试管Ⅰ、Ⅱ、Ⅲ的反应温度不同,说明是探究温度对乙酸乙酯的水解影响,结合总体积必须相等可知,试管Ⅳ和试管Ⅱ应该是探究温度对乙酸乙酯水解程度影响大小的,故氢氧化钠溶液体积应该为3mL,即:V5=3,即:V2=1,V4=5,V5=3;⑥碳酸钠溶液水解显碱性,干扰了探究NaOH溶液对水解速率的影响,所以不能用饱和Na2CO3溶液替代蒸馏水;乙酸乙酯的沸点为77.1℃,水浴温度接近乙酸乙酯的沸点,温度越高,乙酸乙酯挥发也越快,导致试管中酯层减少速率加快,干扰了实验结果。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH H2SO4 NH4ClB.MgO Na2SO4 HNO3
C.HCl Al2O3 MgCl2D.Na2O2 KOH Na3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质A的结构简式为CH3—CH=CH—CH2OH。现有 ①氯化氢、②溴水、③纯碱溶液、④2—丁酸、⑤氢氧化钠溶液,试根据A的结构特点,判断在一定条件下,能与A反应的物质是
A.①②④B.②③④C.①②④⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃蒸气的质量是相同状况下同体积氢气质量的36倍,该烃的化学式是 , 它有种同分异构体,其中沸点最高的是 , 一氯代物只有一种结构的是(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(Br2) | NaOH溶液 | 过滤 |
C | C2H5OH(乙酸) | 新制生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含有 NO、 CO2、NO2、NH3、N2 中的某几种。将 100 mL 甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )

A. NH3、NO2、N2 B. NH3、NO2、CO2 C. NH3、NO、CO2 D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
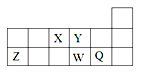
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
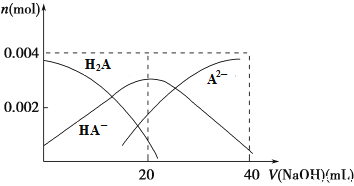
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
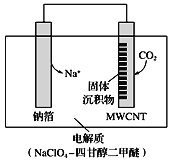
①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com