
【题目】某短周期元素最外层只有2个电子,则该元素一定是
A.第1、2或3周期元素B.最高正价为+2
C.IIA族元素D.金属元素
科目:高中化学 来源: 题型:
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
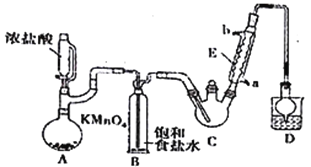
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应: C2H5OH+HCl→C2H5Cl+H2O;
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为_________________________________。
(2)装置B的作用是_________________。该实验在装置中有一处缺陷,即缺少氯气的干燥裝置,缺少该装置可能导致装置C 中副产物______________(填化学式)的量增加;冷凝管的进水口是________(填“a”或“b”);
(3)装置中球形冷凝管的作用是______________________,写出D中所有可能发生的无机反应的离子方程式___________________________________。
(4)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_________________________。
(5)测定产品纯度:称取产品0.50g配成待测溶液,加0.1000 molL-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为_____________;(计算结果保留两位有效数字)滴定的反应原理:CCl3CHO+OH-==CHCl3span>+HCOO- HCOO-+I2== H++2I-+CO2↑ I2+2S2O32-==2I-+ S4O62-
(6)为证明三氯乙酸的酸性比乙酸强。某学习小组的同学设计了以下三种方案,你认为能够达到实验目的的是___________。
a.分别测定0.1mol·L-1两种酸溶液的pH,三氯乙酸的pH 较小
b.用仪器测量浓度均为0.1mol·L-1 的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH 较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
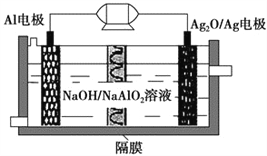
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题: I.将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)=0.1mol/(Lmin).则:
(1)x= .
(2)前5min内B的反应速率v(B)= .
(3)平衡时A的转化率为 .
(4)II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)CO(g)+H2(g)△H. 已知:K(300℃)<K(350℃),则该反应是热反应.
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号. 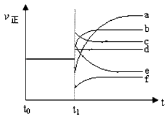
①缩小容器体积; ②降低温度
(6)已知反应①CO(g)+CuO(g)CO2(g)+Cu(s)②H2(g)+CuO(g)Cu(s)+H2O(g) 在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=(用K1和K2表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量很少,但必不可少的微量元素有( )
A. Fe Mn Zn Mg
B. Zn Cu Mn Ca
C. H O Na Mg
D. Zn Cu B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯的说法中正确的是( )
A.乙烯使溴水和酸性高锰酸钾溶液褪色原理相同
B.乙烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为 120°
C.除去乙烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶
D.乙烯和环丙烷( ![]() )的分子组成符合通式 CnH2n , 因此它们属于同系物
)的分子组成符合通式 CnH2n , 因此它们属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中,正确的是
A.将钠与水置于试管中进行反应,可防止反应时钠燃烧
B.钠着火时应用干燥的沙土灭火
C.钠在空气中受热时,熔化为银白色的小球,产生苍白色的火焰
D.取用金属钠可用小刀切割,说明金属钠密度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①写出制取氯气的化学方程式______________。
②该装置的不足之处除无尾气吸收装置外,另一处是______________。
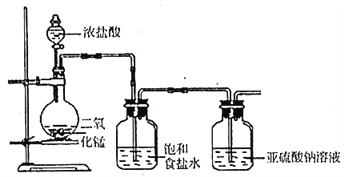
③Cl2与Na2SO3溶液反应的离子方程式为____________。
④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化_________。
(2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四只大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
实验试剂 | 试管I | 试管II | 试管Ⅲ | 试管IV |
乙酸乙酯/mL | 1 | V1 | V2 | V3 |
1mol/LNaOH/mL | V4 | 3 | 0 | V5 |
蒸馏水/mL | 0 | V6 | 5 | 2 |
⑤请完成上表,其中V2=______,V4=______,V5=_______。
⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是____;实验中,试管IV比试管II中的酯层减少更快,其原因有:温度高速率快,还可能有_________。 (乙酸乙酯沸点为77.1℃)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com