
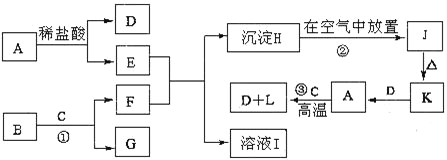
【题目】下列为一些常见物质的相互转化关系图。已知:A是金属单质,B为淡黄色粉末,C在常温下为无色液体,J为红褐色固体。
请写出:
(1)A的化学式:A______________
(2)检验溶液E是否变质的方法_________________________________________________。
(3)固体K的一种用途 __________________________________。
(4)反应①的离子方程式___________________________________________。
(5)物质H转化为物质J的现象为 ________________________________________________________,反应②的化学方程式为 ____________________________________________________________。
(6)反应③的化学方程式___________________________________________。
【答案】 Fe 取少量E溶液于试管中,加入硫氰化钾溶液,若溶液变红色,则变质,无明显变化则没变质 红色油漆或涂料或炼铁原料 2Na2O2 + 2H2O = 4 Na+ + 4 OH-+ O2 ↑ 白色沉淀迅速转化为灰绿色,最后变为红褐色 4Fe(OH)2+ O2+2H2O= 4Fe(OH)3 3Fe + 4 H2O(g)![]() Fe3O4+ 4H2↑
Fe3O4+ 4H2↑
【解析】B为淡黄色粉末,则B为过氧化钠,C在常温下为无色液体,则C为水,两者反应生成F(NaOH)、G(氧气),J为红褐色固体,则J是氢氧化铁,推知H是氢氧化亚铁、由元素守恒可知A为Fe,铁与水蒸气在高温条件下生成氢气和四氧化三铁(L)。
(1)A的化学式:Fe;(2)检验溶液E是否变质,就是检验其中是否含有Fe3+,其方法是取少量E溶液于试管中,加入硫氰化钾溶液,若溶液变红色,则变质,无明显变化则没变质 ;(3)固体K即氧化铁,它的用途之一是红色油漆或涂料或炼铁原料;(4)反应①的离子方程式:2Na2O2 + 2H2O = 4 Na+ + 4 OH-+ O2 ↑;(5)氢氧化亚铁在空气转化为氢氧化铁的现象是白色沉淀迅速转化为灰绿色,最后变为红褐色;此反应的方程式是:4Fe(OH)2+ O2+2H2O= 4Fe(OH)3;(6)铁与水蒸气在高温下反应的化学方程式: 3Fe + 4 H2O(g)![]() Fe3O4+ 4H2↑。
Fe3O4+ 4H2↑。


科目:高中化学 来源: 题型:
【题目】下列关于含氯消毒剂的解释不正确的是
A. 室温下,氯气通入NaOH溶液中制得漂白液 Cl2+2OH-=Cl-+ClO-+H2O
B. 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO
C. 氯水应避光保存的原因是:2HClO![]() H2O+Cl2↑
H2O+Cl2↑
D. 向Ca(ClO)2溶被中通入造量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化学试剂。某实验小组的同学利用浓硫酸进行如下实验。请按要求回答下列问题。
I.制取二氧化硫并探究其性质

(1)装置A中发生反应的化学方程式为___________。上述装置中适于收集二氧化硫的气体是(填字母)____。
(2)将一收集满二氧化硫气体的小试管倒置于滴有紫色石蕊溶液的水中,可观察到的现象是____。
(3)上述实验所产生的二氧化硫尾气可选用E装置来吸收,该反应的化学方程式为_________。
II.处理含正六价铬的废水样液(+6价Cr的含量为78mg/L)。实验步骤如下:
①取1L废水加入一定量1.8mol/LH2SO4溶液使样液酸化
②加入一定量的绿矾(FeSO4·7H2O),将正六价铬转化为正三价铬离子
③加入过量的石灰水,使正三价的铬离子转化为Cr(OH)3沉淀
④过滤,除去沉淀物
(1)配制步骤①中所需的H2SO4溶液l00mL,需用18mol/L H2SO4溶液的体积是______mL。
(2)步骤②中反应的离子方程式为14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O,此反应中氧化剂和还原剂物质的量之比为__________。
(3)处理1L该废水样液至少需用绿矾________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的碱性溶液中,能够大量共存的离子组是()
A. Cu2+、Na+、SO42-、Cl- B. NO3-、Cl-、Ba2+、Mg2+
C. Ba2+、Na+、Cl-、NO3- D. NH4+、Cl+、 H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有﹣OH和位于分子端的﹣C≡C﹣,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1.
(1)写出A的分子式;
(2)写出A的结构简式;
(3)下列物质一定能与A发生反应的是(填序号).
A.H2
B.Na
C.Br2
D.O2(Cu作催化剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯. 
请分析后回答下列问题:
(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式 .
(2)D试管内出现的现象为 .
(3)E试管内出现的现象为 .
(4)三颈烧瓶右侧导管特别长,除导气外还起的作用是 .
(5)反应结束后将三颈烧瓶中的溴苯分离实验方法是 . (铁屑已分离)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( ) 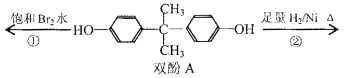
A.双酚A的分子式是C15H16O2
B.反应①中,1mol双酚A最多消耗2mol Br2
C.反应②的产物中只有一种官能团
D.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列:①H2O ②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空. (1﹣4小题填序号)
(1)由离子键和非极性键构成的是
(2)由极性键和非极性键构成的是
(3)不存在化学键的是
(4)离子化合物有
(5)写出Na2O2的电子式:
(6)CO2分子中碳原子采用杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应. 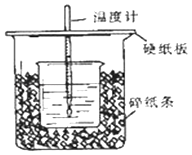
通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称 , 另一处错误是 .
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择molL﹣1的溶液进行实验.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”).
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会;(填“偏大、偏小、无影响”) 如果用60mL0.50mol/L盐酸与50mL0.55mol/L的NaOH溶液所求中和热(填“相等、不相等”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com