
ЁОЬтФПЁПЂйгУ50mL0.50mol/LбЮЫсгы50mLвЛЖЈХЈЖШЕФNaOHШмвКдкШчЭМЫљЪОЕФзАжУжаНјаажаКЭЗДгІЃЎ 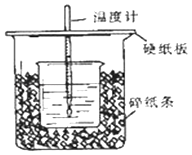
ЭЈЙ§ВтЖЈЗДгІЙ§ГЬжаЫљЗХГіЕФШШСППЩМЦЫужаКЭШШЃЎИУзАжУгаСНДІУїЯдЕФДэЮѓЃЌЦфжавЛДІЪЧШБЩйвЛжжВЃСЇвЧЦїЃЌИУвЧЦїЕФУћГЦ ЃЌ СэвЛДІДэЮѓЪЧ ЃЎ
ЂкЪЕбщЪвЬсЙЉСЫ0.50mol/LКЭ0.55mol/LСНжжХЈЖШЕФNaOHШмвКЃЌгІИУбЁдёmolLЉ1ЕФШмвКНјааЪЕбщЃЎДѓЩеБЩЯШчВЛИЧгВжНАхЃЌЧѓЕУЕФжаКЭШШЪ§жЕЃЈЬюЁАЦЋДѓЁЂЦЋаЁЁЂЮогАЯьЁБЃЉЃЎ
ЂлШчЙћгУЯрЭЌХЈЖШКЭЬхЛ§ЕФДзЫсЃЈCH3COOHЃЉДњЬцHClШмвКНјааЩЯЪіЪЕбщЃЌВтЕУЕФжаКЭШШЕФЪ§жЕЛсЃЛЃЈЬюЁАЦЋДѓЁЂЦЋаЁЁЂЮогАЯьЁБЃЉ ШчЙћгУ60mL0.50mol/LбЮЫсгы50mL0.55mol/LЕФNaOHШмвКЫљЧѓжаКЭШШЃЈЬюЁАЯрЕШЁЂВЛЯрЕШЁБЃЉЃЎ
ЁОД№АИЁПЛЗаЮВЃСЇНСАшАєЃЛаЁЩеБПкКЭДѓЩеБПкУЛгаЦНЦыЃЛ0.55ЃЛЦЋаЁЃЛЦЋаЁЃЛЯрЕШ
ЁОНтЮіЁПНтЃКЂйгЩСПШШМЦЕФЙЙдьПЩжЊИУзАжУЕФШБЩйвЧЦїЪЧЛЗаЮВЃСЇНСАшАєЃЛжаКЭШШВтЖЈЪЕбщГЩАмЕФЙиМќЪЧБЃЮТЙЄзїЃЌФкЭтЩеБЮЊвЛбљИпЃЌЗёдђЃЌШШСПЩЂЪЇДѓЃЛЫљвдД№АИЪЧЃКЛЗаЮВЃСЇНСАшАєЃЛаЁЩеБПкКЭДѓЩеБПкУЛгаЦНЦыЃЛЂкЪЕбщЪвЬсЙЉСЫ0.50molLЉ1КЭ0.55molLЉ1СНжжХЈЖШЕФNaOHШмвКЃЌЮЊСЫЪЙЗДгІГфЗжЃЌNaOHгІЙ§СПЃЌЫљвдбЁдё0.55molLЉ1ЕФШмвКНјааЪЕбщЃЛДѓЩеБЩЯШчВЛИЧгВжНАхЃЌЛсгавЛВПЗжШШСПЩЂЪЇЃЌЧѓЕУЕФжаКЭШШЪ§жЕНЋЛсМѕаЁЃЌЫљвдД№АИЪЧЃК0.55ЃЛЦЋаЁЃЛЂлДзЫсЮЊШѕЫсЃЌЕчРыЙ§ГЬЮЊЮќШШЙ§ГЬЃЌЫљвдДзЫсЃЈCH3COOHЃЉДњЬцHClШмвКЗДгІЃЌЗДгІЗХГіЕФШШСПЦЋаЁЃЌжаКЭШШЕФЪ§жЕЛсЦЋаЁЃЛЗДгІЗХГіЕФШШСПКЭЫљгУЫсвдМАМюЕФСПЕФЖрЩйгаЙиЃЌШчЙћгУ60mL0.50mol/LбЮЫсгы50mL0.55mol/LЕФNaOHШмвКЃЌгыЩЯЪіЪЕбщЯрБШЃЌЩњГЩЫЎЕФСПдіЖрЃЌЫљЗХГіЕФШШСПЦЋИпЃЌЕЋЪЧжаКЭШШЕФОљЪЧЧПЫсКЭЧПМюЗДгІЩњГЩ1molЫЎЪБЗХГіЕФШШЃЌгыЫсМюЕФгУСПЮоЙиЃЌжаКЭШШЪ§жЕЯрЕШЃЛЫљвдД№АИЪЧЃКЦЋаЁЃЛЯрЕШЃЎ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
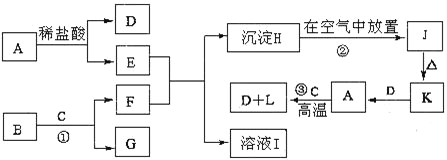
ЁОЬтФПЁПЯТСаЮЊвЛаЉГЃМћЮяжЪЕФЯрЛЅзЊЛЏЙиЯЕЭМЁЃвбжЊЃКAЪЧН№ЪєЕЅжЪЃЌBЮЊЕЛЦЩЋЗлФЉЃЌCдкГЃЮТЯТЮЊЮоЩЋвКЬхЃЌJЮЊКьКжЩЋЙЬЬхЁЃ
ЧыаДГіЃК
ЃЈ1ЃЉAЕФЛЏбЇЪНЃКA______________
ЃЈ2ЃЉМьбщШмвКEЪЧЗёБфжЪЕФЗНЗЈ_________________________________________________ЁЃ
ЃЈ3ЃЉЙЬЬхKЕФвЛжжгУЭО __________________________________ЁЃ
ЃЈ4ЃЉЗДгІЂйЕФРызгЗНГЬЪН___________________________________________ЁЃ
ЃЈ5ЃЉЮяжЪHзЊЛЏЮЊЮяжЪJЕФЯжЯѓЮЊ ________________________________________________________ЃЌЗДгІЂкЕФЛЏбЇЗНГЬЪНЮЊ ____________________________________________________________ЁЃ
ЃЈ6ЃЉЗДгІЂлЕФЛЏбЇЗНГЬЪН___________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗНЗЈФмЙЛГЩЙІжЦБИFe(OH)3НКЬхЕФЪЧЃЈ ЃЉ
A. НЋ1 mLБЅКЭFeCl3ШмвКМгШыЕН20 mL NaOHШмвК
B. НЋ1 mLБЅКЭFeCl3ШмвКж№ЕЮМгШыЕН20 mLЮТЫЎжаЃЌБпМгБпеёЕДЃЌВЂМгШШЕНЗаЬк
C. НЋ1 mLБЅКЭFeCl3ШмвКвЛДЮадМгШыЕН20 mLЗаЫЎжаЃЌВЂМгвдНСАш
D. НЋ5-6ЕЮБЅКЭFeCl3ШмвКж№ЕЮМгШыЕН20 mLЗаЫЎжаЃЌМЬајжѓЗажСГЪКьКжЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаЪмЪЏгЭМлИёгАЯьзюаЁЕФЪЧЃЈ ЃЉ
A.ОлввЯЉ
B.КЯГЩЯДЕгМС
C.ВёгЭ
D.ЗЪдэ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёЁЂЪЕбщЪвПЩвдгУKMnO4ЙЬЬхКЭХЈбЮЫсЗДгІжЦШЁЩйСПCl2ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК2KMnO4+16HClЃЈХЈЃЉЈT2KCl+2MnCl2+5Cl2Ёќ+8H2OЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉИУЗДгІжаБЛбѕЛЏЕФдЊЫиЪЧ__________ЃЎ
ЃЈ2ЃЉбѕЛЏадЃКKMnO4__________Cl2ЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉ
ЃЈ3ЃЉИУЗДгІжабѕЛЏМСКЭбѕЛЏВњЮяЕФЮяжЪЕФСПжЎБШЮЊ__________ЃЎ
ЃЈ4ЃЉгУЫЋЯпЧХЗЈБэЪОИУЗДгІжаЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЃК_________
2KMnO4+16HClЃЈХЈЃЉЈT2KCl+2MnCl2+5Cl2Ёќ+8H2O
ЃЈ5ЃЉУПЩњГЩБъзМзДПіЯТ2.24L Cl2ЃЌЗДгІжазЊвЦЕчзгЕФЮяжЪЕФСПЮЊ__________ЃЎ
ЂђЁЂЪЕбщЪвГЃгУвдЯТЗНЗЈжЦШЁТШЦјЃКMnO2ЃЋ4HCl(ХЈ)![]() MnCl2ЃЋCl2ЁќЃЋ2H2OЧыФуИљОнЫљбЇжЊЪЖЛиД№ЯТСаЮЪЬтЃК
MnCl2ЃЋCl2ЁќЃЋ2H2OЧыФуИљОнЫљбЇжЊЪЖЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉАбТШЦјЭЈШызЯЩЋЪЏШяЪдвКжаЃЌПЩвдЙлВьЕНЕФЯжЯѓЪЧЃК________________ЃЌЧыФуНтЪЭЦфжаЕФдвђ __________________________________________________
ЃЈ2ЃЉЮЊБЃжЄЪЕбщАВШЋЃЌГЃгУNaOHШмвКЮќЪеЖргрЕФТШЦјЁЃаДГіЗДгІЕФЛЏбЇЗНГЬЪН__________________________________ЃЛ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
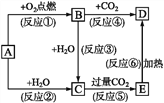
ЁОЬтФПЁПЯТСаЭМЪОжаЃЌAЪЧвЛжжГЃМћЕФЕЅжЪЃЌBЁЂCЁЂDЁЂEЪЧКЌAдЊЫиЕФГЃМћЛЏКЯЮяЃЌЫќУЧЕФбцЩЋЗДгІЕФЛ№бцОљГЪЛЦЩЋЁЃ
ЬюаДЯТСаПеАз:
(1)аДГіЛЏбЇЪН:A_____ЃЌB_____ЃЌD______________ЁЃ
(2)вдЩЯЗДгІжаЪєгкбѕЛЏЛЙдЗДгІЕФга_____(ЬюађКХ)ЁЃ
(3)аДГіЗДгІЂнЕФРызгЗНГЬЪН:___ЁЃаДГіЗДгІЂоЕФЛЏбЇЗНГЬЪН:___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮЂСЃжЛОпгабѕЛЏадЕФЪЧЃК
A. Cu B. Cl- C. Cu2+ D. Cl2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNH4AlЃЈSO4ЃЉ2ЪЧЪГЦЗМгЙЄжазюЮЊПьНнЕФЪГЦЗЬэМгМСЃЌгУгкБКПОЪГЦЗжаЃЛNH4HSO4дкЗжЮіЪдМСЁЂвНвЉЁЂЕчзгЙЄвЕжагУЭОЙуЗКЃЌЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЯрЭЌЬѕМўЯТЃЌpHЯрЭЌЕФNH4AlЃЈSO4ЃЉ2жаcЃЈNH4+ЃЉЃЈЬюЁА=ЁБЁЂЁАЃОЁБЛђЁАЃМЁБЃЉNH4HSO4жаcЃЈNH4+ЃЉЃЎ
ЃЈ2ЃЉШчЭМ1ЪЧ0.1molLЉ1ЕчНтжЪШмвКЕФpHЫцЮТЖШБфЛЏЕФЭМЯѓЃЎ 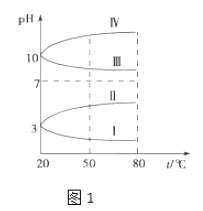
ЂйЦфжаЗћКЯ0.1molLЉ1NH4AlЃЈSO4ЃЉ2ЕФpHЫцЮТЖШБфЛЏЕФЧњЯпЪЧЃЈЬюаДзжФИЃЉЃЛ
ЂкЪвЮТЪБЃЌ0.1molLЉ1NH4AlЃЈSO4ЃЉ2жа2cЃЈSO42ЉЃЉЉcЃЈNH4+ЃЉЉ3cЃЈAl3+ЃЉ=molLЉ1ЃЈЬюЪ§жЕЃЉ
ЃЈ3ЃЉЪвЮТЪБЃЌЯђ100mL 0.1molLЉ1NH4HSO4ШмвКжаЕЮМг0.1molLЉ1NaOHШмвКЃЌЕУЕНЕФШмвКpHгыNaOHШмвКЬхЛ§ЕФЙиЯЕЧњЯпШчЭМ2ЫљЪОЃЎ 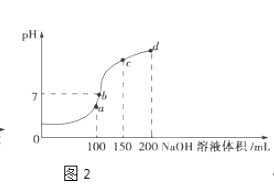
ЪдЗжЮіЭМжаaЁЂbЁЂcЁЂdЫФИіЕуЃЌЫЎЕФЕчРыГЬЖШзюДѓЕФЪЧЃЛдкcЕуЃЌШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФХХСаЫГађЪЧ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗжРыЛьКЯЮядкЙЄвЕЩњВњжагІгУЙуЗКЃЎФГКЌгаН№ЪєЮйЃЈWЃЉЁЂWO2ЁЂWO3ЁЂW2O5ЕФЛьКЯЮяЃЌгћДгИУЛьКЯЮяжаЗжРыГіWO3КЭW2O5ЃЌВЂвБСЖН№ЪєЮйЃЌЦфСїГЬШчЭМЫљЪОЃЎ
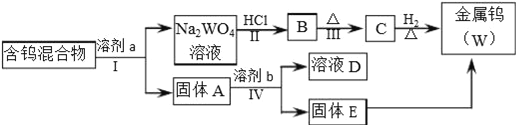
ЧыдФЖСзЪСЯПЈЦЌВЂЛиД№ЯТСаЮЪЬтЃЎ
ЁОзЪСЯПЈЦЌЁП
iЃЎWO3взШмгкNaOHЁЂNa2CO3КЭNa2C2O4ЃЈВнЫсФЦЃЉШмвКВЂаЮГЩЮйЫсбЮЃЈNa2WO4ЃЉЃЛW2O5взБЛбѕЛЏЃЌвВФмШмНтдкЩЯЪіШмвКжаЃЛН№ЪєЮйКЭWO2ВЛШмгкЩЯЪіШмвКЃЎ
iiЃЎWO3МИКѕВЛгыЮоЛњЫсЗДгІЃЎ
iiiЃЎЮйЛЏКЯЮядкВЛЭЌШмМСжаЕФНўШЁТЪМћЯТБэЃЈНўШЁЪЧгУШмМСШмНтЙЬЬхЛьКЯЮяЃЌвдЗжРыПЩШмадзщЗжМАВадќЕФЙ§ГЬЃЎШєНўШЁТЪЮЊ100%ЃЌдђЙЬЬхжаЕФПЩШмзщЗжШЋВПШмНтдкШмМСжаЃЉЃЎ
ШмМС | жѓЗаЪБМфЃЈminЃЉ | W2O5ЃЈ%ЃЉ | WO3ЃЈ%ЃЉ | WO2 | Н№ЪєЮй |
Ђй100g/L NaOH Ђк300g/LNa2CO3 Ђл50g/L Na2CO3 ЂмБЅКЭNa2C2O4 ЂнБЅКЭNa2C2O4ЃЈдкCO2ЦјЗеЯТНўШЁЃЉ | 25 7 30 60 120 | 72.3 76.4 100 4.2 ЃМ0.5 | 100 100 100 100 100 | ЮДМьГі | ЮДМьГі |
ЃЈ1ЃЉВНжшЂёКЭЂєОљвЊНјааЕФВйзїЪЧ_______________________________________ЁЃ
ЃЈ2ЃЉВНжшЂђЁЂЂѓЗДгІЕФЛЏбЇЗНГЬЪНЗжБ№ЪЧ_____________ЁЂ_____________ЁЃ
ЃЈ3ЃЉWO3МШЪєгкН№ЪєбѕЛЏЮяЃЌвВЪєгк____ЃЈЬюЁАЫсадЁБЁЂЁАМюадЁБЃЉбѕЛЏЮяЃЌгыNaOHШмвКЗДгІЕФРызгЗНГЬЪНЪЧ___________________________ЃЎ
ЃЈ4ЃЉВНжшЂёЪЧНЋWO3ЗжРыГіРДЃЌбЁгУЕФЪдМСaЪЧЂнЃЌРэгЩЪЧ______ЃЎ
ЃЈ5ЃЉВНжшЂєПЩНЋW2O5ЗжРыГіРДЃЌбЁгУЕФЪдМСbЪЧ____ЃЌЙЬЬхEжаКЌгаЕФЮяжЪЪЧ___ЃЌDжаЕФШмжЪЪЧ____ЃЎ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com