
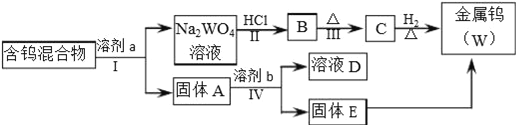
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是_______________________________________。
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是_____________、_____________。
(3)WO3既属于金属氧化物,也属于____(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是___________________________.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是______.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是____,固体E中含有的物质是___,D中的溶质是____.
【答案】 过滤 Na2WO4+2HCl=H2WO4+2NaCl H2WO4![]() WO3+H2O 酸性 WO3+2OH﹣=WO42﹣+H2O 将WO3溶解同时又能保证不被氧化W2O5 50g/L Na2CO3溶液 W、WO2 钨酸钠(Na2WO4)
WO3+H2O 酸性 WO3+2OH﹣=WO42﹣+H2O 将WO3溶解同时又能保证不被氧化W2O5 50g/L Na2CO3溶液 W、WO2 钨酸钠(Na2WO4)
【解析】步骤Ⅰ是将WO3分离出来,步骤Ⅳ可将W2O5分离出来,根据钨化合物在不同溶剂中的浸取率可知,试剂a应为饱和Na2C2O4(在CO2气氛下浸取),金属钨(W)、WO2、WO3、W2O5的混合物中WO3溶解生成Na2WO4,与酸反应得B为H2WO4,B受热分解得C为WO3,C被还原得W,固体A应为W、WO2、W2O5的混合物,W2O5在50g/L Na2CO3溶液中的浸取率为100%,所以将固体A用50g/L Na2CO3溶液浸取,W2O5溶于Na2CO3溶液,并能被空气中氧气氧化得D溶液应为Na2WO4溶液,过滤得到固体E为金属钨(W)、WO2的混合物,E被还原得到W,则
(1)步骤Ⅰ和Ⅳ均要分离固体和液体,所以用到的操作为过滤;(2)步骤Ⅱ为与酸反应生成钨酸,反应方程式为Na2WO4+2HCl=H2WO4+2NaCl,Ⅲ反应为钨酸受热分解,反应的化学方程式为H2WO4![]() WO3+H2O;(3)WO3既属于金属氧化物,能与氢氧化钠反应,所以也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH﹣=WO42﹣+H2O;(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是饱和Na2C2O4(在CO2气氛下浸取),根据钨化合物在不同溶剂中的浸取率可知,这样可以将WO3溶解同时又能保证不被氧化W2O5,以便在步骤Ⅳ中将W2O5分离出来;(5)根据上面的分析可知,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4。
WO3+H2O;(3)WO3既属于金属氧化物,能与氢氧化钠反应,所以也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH﹣=WO42﹣+H2O;(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是饱和Na2C2O4(在CO2气氛下浸取),根据钨化合物在不同溶剂中的浸取率可知,这样可以将WO3溶解同时又能保证不被氧化W2O5,以便在步骤Ⅳ中将W2O5分离出来;(5)根据上面的分析可知,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4。


科目:高中化学 来源: 题型:
【题目】①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应. 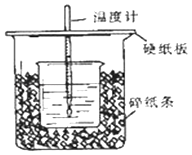
通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称 , 另一处错误是 .
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择molL﹣1的溶液进行实验.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”).
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会;(填“偏大、偏小、无影响”) 如果用60mL0.50mol/L盐酸与50mL0.55mol/L的NaOH溶液所求中和热(填“相等、不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( ) 
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中能产生白色沉淀,说明SO2具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: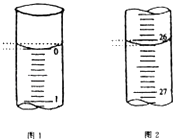
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验。
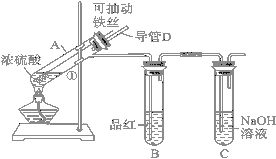
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是________________。
(2)说明SO2气体产生的实验现象是___________;装置C的作用是______________。
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
① 提出假设: 假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+。
② 请设计实验方案验证假设3。
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液。
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 |
|
步骤二:检验Fe3+,往试管Ⅰ中,_____________ | _________________________ |
步骤三:检验Fe2+,往试管Ⅱ中,______________ | _________________________ |
(4)已知C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序为_____________________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅及其化合物用途的叙述中,正确的有( )
A.Na2SiO3可用作助燃剂
B.SiO2可用作制造光导纤维
C.单晶硅可用于制造太阳能电池
D.Si可用作制造变压器铁芯的原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com