
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ũ��������ʣ����������ͼ��ʾ��װ�ý���ʵ�顣
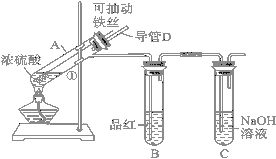
��1���á��ɳ鶯����˿�����桰ֱ��Ͷ����Ƭ�����ŵ���________________��
��2��˵��SO2���������ʵ��������___________��װ��C��������______________��
��3����Ӧһ��ʱ������Ƕ��Թ�A����Һ�Ľ������ӽ���̽���������������⣺
�� ������裺 ����1��ֻ����Fe3����
����2��ֻ����Fe2����
����3������Fe2��������Fe3����
�� �����ʵ�鷽����֤����3��
��ѡ�Լ���ϡ���ᡢKMnO4��Һ��KSCN��Һ��NaOH��Һ��H2O2��Һ��
ʵ�鲽�� | Ԥ������ |
����һ���ý�ͷ�ι�ȡ��A�Թ��е���Һ����ˮϡ�ͺ���װ���Թܢ��б��� |
|
�����������Fe3�������Թܢ��У�_____________ | _________________________ |
������������Fe2�������Թܢ��У�______________ | _________________________ |
��4����֪C��2H2SO4(Ũ)![]() 2SO2����CO2����2H2O���÷�Ӧ����Ũ�����_____
2SO2����CO2����2H2O���÷�Ӧ����Ũ�����_____
A����ˮ�ԡ� B��ǿ�����ԡ� C����ˮ��
��Ҫ��֤��Ӧ������ͬʱ����SO2�����CO2���壬��ѡ�������Լ�����ʵ�飺
NaOH��Һ ��Ʒ����Һ ����ˮ ��Ca(OH)2��Һ
ѡ������Լ��������ź�����˳��Ϊ_____________________������ţ���
���𰸡� ����ʱ���Ʒ�Ӧ�Ľ��к�ֹͣ Ʒ����ɫ ���ն����SO2���壬��ֹβ����Ⱦ�������� ���뼸��KSCN��Һ ��Һ����Ѫ��ɫ ��������KMnO4��Һ�����ȵ��뼸��ϡ���ᣩ �Ϻ�ɫ��dz������ B �ڢۢڢ�
����������1���ڼ��ȵ������£�����˿��Ũ����Ӵ�ʱ���ܷ�Ӧ�������ϳ鶯��˿ʱ����˿������Ӵ�����Ӧֹͣ�������á��ɳ鶯����˿�����ŵ��ǿ���ʱ���Ʒ�Ӧ�Ľ��к�ֹͣ����2��SO2����Ư���ԣ�Ʒ����Һ�ܱ���������Ư�ף�����Ʒ����Һ��֤SO2�����ɣ�������˵����SO2���������ʵ��������Ʒ����Һ��ɫ������������ж��ԣ��ܱ������������գ����װ��C�����������ն����SO2���壬��ֹβ����Ⱦ������������3�����ʵ�鷽����֤����3������֤Fe3+��Fe2+������һ���ý�ͷ�ι�ȡA�Թ��е���Һ����ˮϡ�Ͳ���װ�Թ�I��II���ã�����������Թ�I�У��μ�������KSCN��Һ����Һ����Ѫ��ɫ����˵��ԭ��Һ�к���Fe3+�������������Թ�II�μӵ�������KMnO4��Һ��Fe2+�ܻ�ԭ����������ӣ�����Һ��ɫ����˵��ԭ��Һ�к���Fe2+����4����ӦC��2H2SO4(Ũ)![]() 2SO2����CO2����2H2O��̼���ʱ�Ũ�����������÷�Ӧ����Ũ�����ǿ�����ԣ���ѡB����Ҫ��֤��Ӧ������ͬʱ����SO2�����CO2���壬����SO2�ܸ���CO2�ļ��飬�����ȼ�����������ٳ����������������������̼���ɣ����ѡ���Լ����ź�����˳��Ϊ�ڢۢڢ���
2SO2����CO2����2H2O��̼���ʱ�Ũ�����������÷�Ӧ����Ũ�����ǿ�����ԣ���ѡB����Ҫ��֤��Ӧ������ͬʱ����SO2�����CO2���壬����SO2�ܸ���CO2�ļ��飬�����ȼ�����������ٳ����������������������̼���ɣ����ѡ���Լ����ź�����˳��Ϊ�ڢۢڢ���


 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�У�A��һ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ�Ļ�����ʻ�ɫ��
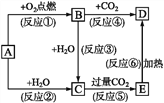
��д���пհ�:
(1)д����ѧʽ:A_____��B_____��D______________��
(2)���Ϸ�Ӧ������������ԭ��Ӧ����_____(�����)��
(3)д����Ӧ�ݵ����ӷ���ʽ:___��д����Ӧ�Ļ�ѧ����ʽ:___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Xԭ��ת��2�����Ӹ�Yԭ�ӣ��γɻ�����XY������˵������ȷ���ǣ� ��
A. X�������� B. X��������
C. X�����˻�ԭ��Ӧ D. Y�ڷ�Ӧ�б��ֳ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������( )
A. ��������ƽ��ȡ3.2 g NaCl����
B. ���˺�������ƿת��Һ��ʱ����������������ͬ
C. ����ƿʹ��ǰӦϴ�ӡ������©
D. ����ʱ����ˮ���������̶��ߣ�ֻ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ�ҵ������Ӧ�ù㷺��ij���н����٣�W����WO2��WO3��W2O5�Ļ������Ӹû�����з����WO3��W2O5����ұ�������٣���������ͼ��ʾ��
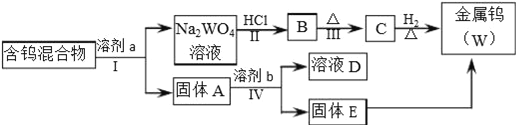
���Ķ����Ͽ�Ƭ���ش��������⣮
�����Ͽ�Ƭ��
i��WO3������NaOH��Na2CO3��Na2C2O4�������ƣ���Һ���γ������Σ�Na2WO4����W2O5�ױ�������Ҳ���ܽ���������Һ�У������ٺ�WO2������������Һ��
ii��WO3�����������ᷴӦ��
iii���ٻ������ڲ�ͬ�ܼ��еĽ�ȡ�ʼ��±�����ȡ�����ܼ��ܽ��������Է����������ּ������Ĺ��̣�����ȡ��Ϊ100%��������еĿ������ȫ���ܽ����ܼ��У���
�ܼ� | ���ʱ�䣨min�� | W2O5��%�� | WO3��%�� | WO2 | ������ |
��100g/L NaOH ��300g/LNa2CO3 ��50g/L Na2CO3 �ܱ���Na2C2O4 �ݱ���Na2C2O4����CO2�����½�ȡ�� | 25 7 30 60 120 | 72.3 76.4 100 4.2 ��0.5 | 100 100 100 100 100 | δ��� | δ��� |
��1�������͢���Ҫ���еIJ�����_______________________________________��
��2�������Ӧ�Ļ�ѧ����ʽ�ֱ���_____________��_____________��
��3��WO3�����ڽ��������Ҳ����____������ԡ��������ԡ����������NaOH��Һ��Ӧ�����ӷ���ʽ��___________________________��
��4��������ǽ�WO3���������ѡ�õ��Լ�a�Ǣݣ�������______��
��5��������ɽ�W2O5���������ѡ�õ��Լ�b��____������E�к��е�������___��D�е�������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������������A,B,C,D,E,F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��Cλ��ͬһ���壬F��ԭ������Ϊ24��
��1��Fԭ�ӻ�̬�ĺ�������Ų�ʽΪ ��
��2����A,B,C����Ԫ���У���һ�������ɴ�С��˳��������Ԫ�ط��Żش𣩣�
��3��Ԫ��B�ļ���̬�⻯��ķе�Զ����Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ���� ��
��4����A,B,C�γɵ�����CAB����AC2��Ϊ�ȵ����壬��CAB���ĽṹʽΪ ��
��5����Ԫ��A��E���γɵij����������У�Aԭ�ӹ�����ӻ�����Ϊ ��
��6����B,C,D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���϶�����ͬ��Ԫ�����������Ƶ��ǣ� ��
A.ԭ�Ӻ�������Ų�ʽ��AΪ1s22s2 �� BΪ1s2
B.�ṹʾ��ͼ��AΪ ![]() ��BΪ
��BΪ ![]()
C.Aԭ�ӻ�̬ʱ2p�������1��δ�ɶԵ��ӣ�Bԭ�ӻ�̬ʱ3p�����Ҳ��1��δ�ɶԵ���
D.Aԭ�ӻ�̬ʱ2p�������һ�ԳɶԵ��ӣ�Bԭ�ӻ�̬ʱ3p�����Ҳ��һ�ԳɶԵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ȷ���ǣ� ��
A.�����۵�ĸߵͣ� ��
�� 
B.Ӳ���ɴ�С�����ʯ��̼���裾�����
C.�۵��ɸߵ��ͣ�Na��Mg��Al
D.�������ɴ�С��NaF��NaCl��NaBr��NaI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽ������ȷ���ǣ� �� �ٳ����£�pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������ϣ�����c��Na+��+c��H+��=c��OH����+c��CH3COO����
�ڶ��ѽ�����ѧƽ���ij���淴Ӧ�����ı�����ʹ��ѧƽ��������Ӧ�����ƶ�ʱ��������İٷֺ���һ������
�۳����£�AgCl��ͬ���ʵ���Ũ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ
�ܳ����£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw��KaKh=Kw
�ݵ�⾫��ͭʱ���������Һ��ͭ����Ũ�Ȳ��䣮
A.�٢�
B.�٢ڢ�
C.�٢ڢܢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com