
分析 中学化学中常见由短周期元素组成的有色物质,且它们均能与水发生氧化还原反应但水既不是氧化剂也不是还原剂,符合条件的物质有Cl2、NO2、Na2O2,A、B、C的相对分子质量由小到大,则A为NO2,B为Cl2,C为Na2O2,据此分析解答.
解答 解:中学化学中常见由短周期元素组成的有色物质,且它们均能与水发生氧化还原反应但水既不是氧化剂也不是还原剂,符合条件的物质有Cl2、NO2、Na2O2,A、B、C的相对分子质量由小到大,则A为NO2,B为Cl2,C为Na2O2,
①二氧化氮和水反应方程式为3NO2+H2O=2HNO3+NO;
②氯气和水反应方程式为Cl2+H2O=HCl+HClO;
③过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑;
故答案为:①3NO2+H2O=2HNO3+NO;②Cl2+H2O=HCl+HClO;③2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查无机物推断,为高频考点,侧重考查学生对元素化合物性质的掌握和灵活运用,明确参加物质颜色、状态、性质是解本题关键,熟练掌握元素化合物性质并注意基础知识的积累归纳,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA | |
| B. | 1 mol-OH中电子数为10 NA | |
| C. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| D. | 常温常压下,28 g丙烯和丁烯的混合气体中含有的碳原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
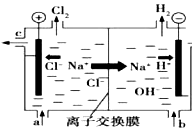 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

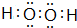 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl是电解质,故NaCl晶体能导电 | |
| B. | 浓溶液的导电能力一定强 | |
| C. | NH4NO3电离时产生了NH4+、NO3-,无金属离子,所以NH4NO3不是盐 | |
| D. | 熔融状态下 NaHSO4的电离方程式为:NaHSO4=Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
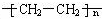 ,属于加聚反应.
,属于加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com