
| |||||||||||||||||||||||||
(1) |
本题考查对中和热的有关问题,对中和热概念的理解,应着重抓住三个点“稀”、“强”、“1 mol”.A应注意判断,虽然H2SO4是二元酸,但是发生反应时,NaOH不足,所以仍是只生成1 mol H2O,所测即是中和热;B中忽略了“稀”;C中忽视了“强”;D中忽视了“稀”,同时也有可能有其他的离子键生成,如有BaSO4生成. |
(2) |
答案:环形搅拌器,温度计,大烧杯,小烧杯,量筒,暖瓶(或保温瓶) 思路与技巧:本题是对中和热测定实验理论上的深入理解与思考,注意审题——测定所需的玻璃容器;另外题目中的信息对做题有一定的提示,指出中和热测定实验的关键是量热器要尽量做到绝热,这也是对信息利用能力的考查,根据此信息,考虑生活中可以保证绝热的仪器,就是保温瓶. |
(3) |
不影响生成1 mol H2O,不影响“稀”,但能够加速反应,且使反应进行完全,使测量的误差减小 |
|
抓住对实验测定机理的理解,与生活相联系,将化学与生活结合,是一种实际应用能力的考查. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)做一次完整的中和热实验,温度计需要使用______ 次;
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C = 4.18 J/(g·℃),反应后温度升高了△t, 则生成1mol水时的反应热ΔH=___________kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),简述理由 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省铜陵一中高二10月月考化学试卷(带解析) 题型:实验题
(12分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:_________ ___________,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____ _______________。
(2)该实验可用0.60 mol·L-1 HCl和0.65 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___ __。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为_____________kJ(填表达式),ΔH="___________" kJ/mol(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高二10月月考化学试卷(解析版) 题型:实验题
(12分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:_________ ___________,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____ _______________。
(2)该实验可用0.60 mol·L-1 HCl和0.65 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___ __。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为_____________kJ(填表达式),ΔH=___________ kJ/mol(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高一下学期期初考试化学试卷(解析版) 题型:实验题
(14分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
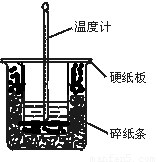
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)做一次完整的中和热实验,温度计需要使用______ 次;
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C = 4.18 J/(g·℃),反应后温度升高了△t, 则生成1mol水时的反应热ΔH=___________ kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com