
 要破坏共价键的是 ,熔点最低的是 。
要破坏共价键的是 ,熔点最低的是 。 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:不详 题型:单选题
| A.含有共价键的化合物一定是共价化合物 |
| B.晶体中一定存在化学键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.金属键越强,金属越活泼,金属熔点越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物 质 | MgO | CaO | ZnCl2 | ZnBr2 |
| 干燥效率 | 0.008 | 0.2 | 0.8 | 1.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

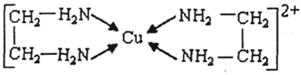
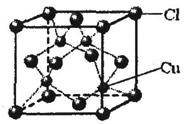
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 元素 | o | P | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

 键, 个
键, 个 键。
键。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅、氢氧化钠、萘 | B.钠、钾、铯 |
| C.干冰、氧化镁、磷酸 | D.C2H6、C(CH3)4、CH3(CH2)3CH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li、Na、K、Rb的沸点逐渐降低 |
| B.与硅相比,金刚石的硬度大、熔点高 |
| C.HF、HCl、HBr、HI热稳定性依次减弱 |
| D.H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘单质的升华和金刚石的熔化 | B.二氧化硅和氯化钾的熔化 |
| C.氧化铝和冰的熔化 | D.乙醇和液氯的汽化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com