
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了12种元素在周期表中的位置。
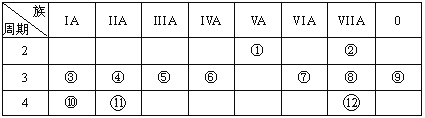
请回答:
(1)写出下列元素名称:①________,⑥________,⑦________。
(2)在①~元素中,金属性最强的元素是___,非金属性最强的素是____,最不活泼的元素是________。(均填元素符号)
(3)元素⑩与水反应的化学方程式__________________________。
(4)②与水的反应方程式______________________。
【答案】氮 硅 硫 K F Ar 2K+2H2O=2KOH+H2↑ 2F2+2H2O=HF+O2
【解析】
根据元素在周期表中的位置可知:①为N元素,②为F元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥为Si元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,⑩为K元素,为Ca元素,为Br元素,结合元素的结构及性质进行答题。
(1)由分析可知:①为氮元素,⑥为硅元素,⑦为硫元素,故答案为:氮,硅,硫。
(2)同一周期,从左向右,元素的金属性逐渐减弱,非金属性逐渐增强,同一主族,自上而下,元素的金属性逐渐增强,非金属性逐渐减弱,所以金属性最强的元素是K,非金属性最强的素是F,最不活泼的元素是Ar,故答案为:K,F,Ar。
(3)⑩为K元素,单质钾与水反应生成氢氧化钾和氢气,反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:2K+2H2O=2KOH+H2↑。
(4)②为F元素,单质氟与水反应生成氟化氢和氧气,反应方程式为:2F2+2H2O=HF+O2,故答案为:2F2+2H2O=HF+O2。


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是

A. 利用甲装置,验证SO2或H2SO3具有氧化性
B. 利用乙装置,验证元素的非金属性:C1>C>Si
C. 利用丙装置,进行NH3的干燥、收集、尾气处理
D. 利用丁装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在鉴定还原糖的实验中,加入斐林试剂时,必须要
A. 先加入斐林试剂甲液,后加入乙液
B. 将斐林试剂的甲液和乙液等量混合均匀后再加
C. 先加入斐林试剂乙液,后加入甲液
D. 以上A、B、C三项操作方法都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是

A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2-8e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是
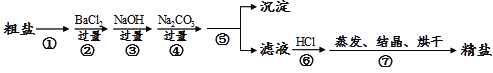
A. 实验过程中①、⑤步骤的操作分别是溶解、过滤
B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+
C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
D. 实验过程中②、④步骤互换,对实验结果不影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com