
| A、0.5 molAl与足量盐酸反应转移电子数为1NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、0.1molCH4所含的电子数为1NA |
| D、46gNO2和N2O4的混合物含有的分子数为1NA |


科目:高中化学 来源: 题型:
| A、颗粒状单质锶投入CuSO4溶液中,能置换出金属铜 |
| B、颗粒状的单质锶跟稀硫酸反应,不如钠和水反应那么剧烈 |
| C、锶在纯氧中点燃可燃烧 |
| D、锶的碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①中碳是还原剂 |
| B、反应①中TiO2是氧化剂 |
| C、反应②表现了金属镁还原性比金属钛强 |
| D、反应①氧化剂与还原剂的物质的量的关系为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
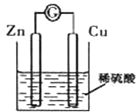
| A、铜为负极,产生气泡 |
| B、溶液变蓝色 |
| C、电子从锌极经导线流向铜极 |
| D、Zn、Cu 分别接外加电源的正、负极可在锌极镀上铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:
| ||
| D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的摩尔质量是18g |
| B、2mol水的摩尔质量是1mol水摩尔质量的2倍 |
| C、任何物质的摩尔质量都就是它的相对分子质量或相对原子质量 |
| D、水的摩尔质量是氢气摩尔质量的9倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于键能EH-F>EH-Cl,故氢化物的沸点:HF>HCl |
| B、由于分子中可电离的H+个数H2SO4>CH3COOH,故两者的酸性:H2SO4>CH3COOH |
| C、由于元素的非金属性N>P,故最高价氧化物的水化物的酸性:HNO3>H3PO4 |
| D、由于氧化性Fe3+>Cu2+,故还原性Fe2+>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知常温下pH=2的高碘酸(H3IO5)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性;0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈中性.请回答下列问题:
(1)已知常温下pH=2的高碘酸(H3IO5)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性;0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈中性.请回答下列问题:| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com