
对盆栽鲜花施用了S-诱抗素制剂可保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法正确的是 ( )

A.其分子式为C15H22O4
B.1 mol该物质与NaOH溶液反应,最多消耗2 molNaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高二化学试卷(解析版) 题型:选择题
分子中含有5个碳原子的饱和一元醇,发生氧化后能生 成醛的种数与发生消去反应后生成烯烃的种数分别为 :( )
成醛的种数与发生消去反应后生成烯烃的种数分别为 :( )
A.5、6 B.4、5 C.4、6 D.5、5
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
最近科学家发现了氧元素的一种新的粒子O4,对于这种新粒子,下列说法不正确的是( )
A.它是氧气的一种同素异形体 B.它是氧元素的一种同位素
C.它的摩尔质量是64 g·mol-1 D.它具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:实验题
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。
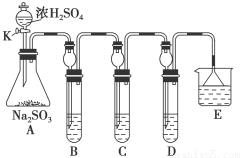
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
实验操作 | 预期现象和结论 |
将D中沉淀过滤,洗涤干净备用 |
|
用另一干净试管取少量沉淀样品,加入 ______ | __________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列各项化学用语中表示正确的是( )
A.Na2O2的电子式为: 
B.丙烷分子的比例模型为:
C.甲醛的结构简式:HCHO
D.聚丙烯的结构简式为:
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是( )
A.10 min内,T1时CH4的化学反应速率比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______。
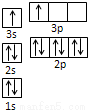
②ACl2分子中A的杂化类型为__________,ACl2空间构型为__________。
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱。D是周期表中电负性最大的元素。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物。请根据上述信息。
①写出E元素原子基态时的电子排布式____________________。
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为__________。
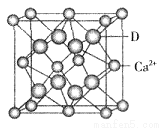
③D与Ca2+可形成离子化合物,其晶胞结构如图所示。其中Ca2+离子的配位数为__________,若该晶体的密度为ag/cm3,则该晶胞的体积是__________cm3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:填空题
(15分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2 g苯甲酸和20 mL甲醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
⑴浓硫酸的作用是________________________________________ _________;
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
___________________________________________________。
⑵甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲 酯的装置 (夹持仪器和加热仪器均已略去)。
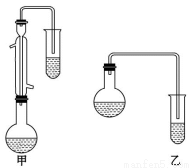
根据有机物的沸点,最好采用______(填“甲”或“乙”)装置。
理由是______________________________________________。
⑶若要提高苯甲酸甲酯的产率,可采取的措施_
______ _。(任写一条)
Ⅱ.粗产品的精制
⑷苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称。

⑸通过计算,苯甲酸甲酯的产率为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com