
【题目】有图1、2所示的装置,下列叙述正确的是( )
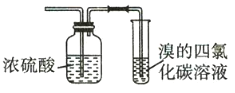
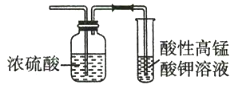
图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过如图所示途径合成: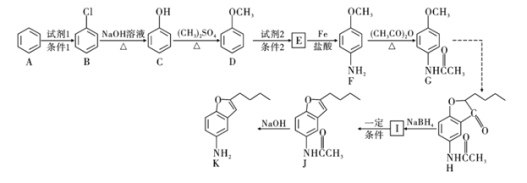
已知:![]()
![]() ;
;![]() 苯胺易被氧化
苯胺易被氧化![]() ;
;
![]()
![]() 。
。
回答下列问题:
(1)写出化合物D的名称为______________,F中的非含氧官能团名称为______________
(2)写出![]() 的反应类型:______________,化合物G的分子式为______________。
的反应类型:______________,化合物G的分子式为______________。
(3)写出![]() 反应的化学方程式:__________________________________________。
反应的化学方程式:__________________________________________。
(4)化合物L是E同分异构体,写出同时满足下列条件L的其中一种结构简式:____________________________。
①能与![]() 溶液反应显紫色
溶液反应显紫色
②苯环上有三个取代基,其中一个为![]()
③苯环上的一氯取代有两种同分异构体
(5)合成途径中,F转化为G的目的是___________________________________。
(6)参照上述合成路线,以苯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备![]() 的合成路线。________________
的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱、核磁共振、X射线衍射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构研究等。
(1)过渡元素Ni原子的基态电子排布式为____________________,Ni的核外电子由基态跃迁至激发态时产生的光谱是__________(填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。
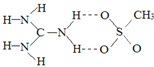
①组成该晶体的元素中第一电离能最大的是_____________,其中C的杂化类型有_______________。
②元素C、N、S的简单氢化物在水中的溶解度从大到小的顺序为__________,原因是__________。
(3)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线衍射分析其晶胞结构如图所示。
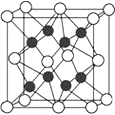
①晶胞中Na堆积形成__________(填形状)空隙,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是_________________________。
②已知晶胞边长为a nm,晶胞中Na的半径为b nm,则He的半径为__________nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
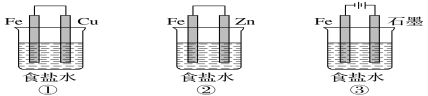
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为_________________。
(2)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为_______________________。
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
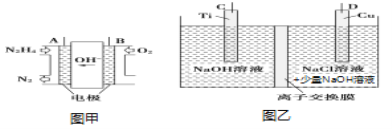
(1)上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”),该电解池中离子交换膜为________离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为____________________。
(3)当反应生成14.4 g Cu2O时,至少需要肼________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.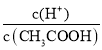 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
若该溶液升高温度,上述4种表达式的数据增大的是________。
(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,醋酸的电离平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________mol·L-1(用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)变为b mol·L-1,则此时c2(H+)=________(用含a、b的代数式表示)mol·L-1。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用双离子交换膜电解法可以处理含NH4NO3的工业废水,原理如图所示,下列叙述错误的是
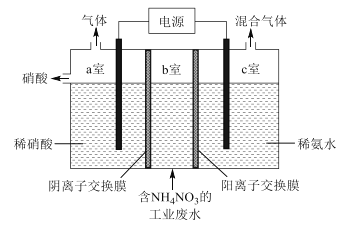
A. NH4+由b室向c室迁移
B. c室得到的混合气体是NH3和H2
C. 阳极反应式为2H2O -4e-=O2+4H+
D. 理论上外电路中流过1mol电子,可处理工业废水中0.5mol NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置研究电化学原理,下列分析中错误的是
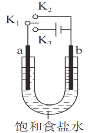
选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生2NO2![]() 2NO+O2,下列说法能够判断该反应达到化学平衡状态的个数是
2NO+O2,下列说法能够判断该反应达到化学平衡状态的个数是
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内NO2、NO、O2的物质的量浓度变化量之比为2︰1︰1
③混合气体的颜色不再改变 ④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变 ⑥混合体系中c(NO)保持不变
A.1个B.2个C.3个D.4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com