
【题目】利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阳极发生还原反应
C.精铜连接电源负极,其电极反应是Cu-2e-=Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,物质的量浓度均为0.1 mol·L-1 Na2CO3和 NaHCO3的等体积混合溶液中: 2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-)
B. △H<0,△S>0的反应都是自发反应,△H>0,△S>0的反应任何条件都是非自发反应
C. 已知:P4(g)+6Cl2(g)=4PCl3(g)△H= akJ·mol-1 P4(g)+10Cl2(g)=4PCl5(g) △H=bkJ·mol-1 P4具有正四面体结构,PCl5中P-Cl键的键能为 ckJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1,由此计算Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D. 在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)=2SO3(g) △H<0,当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol·L-1的浓硫酸来配制500mL 0.5 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是_____________________ 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序 为:②→①→③→____ →____→____→____→④(填序号) ____________
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下面框图进行反应。
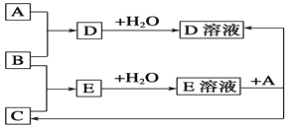
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是_________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的_______,理由是_________________________。
(3)如果E溶液是一种强酸,则E的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子机器设计和合成”有着巨大的研究潜力。人类步入分子器件时代后,使得光控、温控和电控分子的能力更强。如图是蒽醌套索醚电控开关。下列说法错误的是
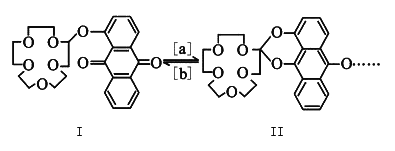
A. 物质Ⅰ的分子式是C25H28O8 B. 反应[a]是氧化反应
C. 1molⅠ可与8molH2发生加成反应 D. 物质Ⅰ的的所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KClO3+6HCl===KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数比为 ( )
A. 1﹕6 B. 6﹕1 C. 1﹕5 D. 5﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
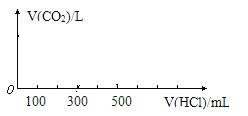
【题目】将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X。
(1)写出碳酸氢钠分解产生的气体分别与过氧化钠反应的化学反应方程式:
_________________、_________________________。
(2)残余固体X的成分是____________。
A.Na2O2、NaOH B.Na2O2、Na2CO3 C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3
(3)向固体X中逐滴加入1mol/L的稀盐酸至不再产生气泡为止,产生的气体在标准状况下的体积为____L。请以V(HCl)为横坐标,V(CO2)为纵坐标,画出产生CO2的体积和加入稀盐酸溶液体积的关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. NaNO2溶液中加入酸性KMnO4溶液:2MnO4﹣+5NO2﹣+6H+═2Mn2++5NO3﹣+3H2O
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3﹣+2OH﹣═CO32﹣+NH3H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
D. 用惰性电极电解熔融氯化钠:2Cl﹣+2H2O═Cl2↑+H2↑+2OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com