
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
分析 A.IA族含H及碱金属元素,ⅦA族均为非金属元素;
B.非金属性越强,简单离子越稳定,失去电子的能力越弱;
C.同周期金属元素的化合价越高,失去电子的能力越弱;
D.第二周期元素中,O、F没有正价.
解答 解:A.IA族含H及碱金属元素,ⅦA族均为非金属元素,则H与ⅦA族元素间可形成共价化合物,碱金属元素与ⅦA族元素间可形成离子化合物,故A正确;
B.同主族元素,从上到下非金属性减弱,则简单阴离子从上到下还原性增强,即:非金属性越强,简单离子的还原性越弱,故B错误;
C.同周期金属元素的化合价越高,金属性越弱,失去电子的能力越弱,如Na、Mg、Al的失去电子能力减弱,故C错误;
D.第二周期元素中,O、F没有正价,则第二周期元素从左到右,最高正价从+1递增到+5,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律的综合应用,题目难度中等,把握同周期、同主族元素性质的变化规律为解答的关键,注意元素性质的特例.


科目:高中化学 来源: 题型:解答题
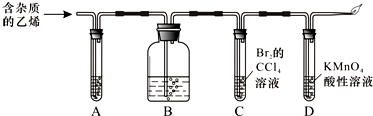
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氨气通入醋酸中:NH3+H+═NH4+ | |
| B. | 在NH4Cl溶液中滴入氢氧化钠溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜屑放入稀硝酸中:Cu+4H++NO3-═Cu2++NO↑+2H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中通入二氧化硫气体 | B. | 向水中加入少量氯化铁固体 | ||
| C. | 将水加热煮沸 | D. | 向水中加入碳酸钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
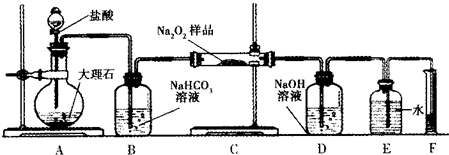
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(Na+) | B. | c(H+)=c(OH-)<c(Na+)<c(A-) | ||
| C. | V(混)≥20mL | D. | V(混)≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1 CH3COOH溶液中含有的CH3COO-为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1 NH4NO3溶液中含有的氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2,同时转移的电子数为6NA | |
| D. | 常温常压下,22.4 L乙烯中含有的共用电子对的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率降低 | ||
| C. | 物质B的质量分数增加 | D. | a<b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com