
| A. | 氨气分子的电子式: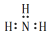 | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
分析 A、氨气分子为共价化合物,N周围满足8电子稳定结构;
B、镁离子的核外有10个电子;
C、乙酸是一个羧基连在一个甲基上构成;
D、能表示物质的元素构成的式子为分子式.
解答 解:A、氨气分子为共价化合物,N周围满足8电子稳定结构,其电子式为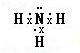 ,故A错误;
,故A错误;
B、镁离子的核内有12个质子,但核外只有10个电子,故结构示意图为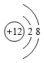 ,故B错误;
,故B错误;
C、乙酸是一个羧基连在一个甲基上构成,故其结构简式为CH3COOH,故C正确;
D、能表示物质的元素构成的式子为分子式,故乙醇的分子式应为C2H6O,故D错误.
故选C.
点评 本题考查了常见的化学用语,难度不大,应注意的是氨气的电子式在书写时,不能漏掉N原子上的未参与成键的孤对电子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | S→SO3可以一步实验 | |
| B. | S是淡黄色固体,易溶于水 | |
| C. | Fe+S→FeS,Fe+Cl2→FeCl3,说明氧化性:Cl2>S | |
| D. | 试管壁上残留的S可以用酒精清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:2H2+4OH--4e-═4H2O | |
| B. | 正极反应为:O2+4H++4e-═2 H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g H2 所含的原子个数 | |
| B. | 4g 氦气所含的原子个数 | |
| C. | 23g 金属 Na 全部转变为金属离子时失去的电子个数 | |
| D. | 16g O2 所含的分子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | Ba(OH)2 | C. | NH4Al(SO4)2 | D. | Na3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、Cl- | |
| B. | PH=0的无色溶液中:Na+、K+、MnO4-、NO3- | |
| C. | 在0.1mol/L的盐酸中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在含有大量Fe3+的溶液中:NH4+、Ca2+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com