
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份200mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2=H2O+NO2↑+NO↑)①第一份加足量AgNO3溶液后,有11.68g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100mL0.5mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。
根据上述实验,以下推测不正确的是( )
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
C
解析试题分析:首先对原来的溶液中的微粒进行鉴定。H+和NO2-、CO32-会发生离子反应而不能大量共存;Mg2+和CO32-会发生离子反应而不能大量共存。①第一份加足量AgNO3溶液后,有11.68g白色沉淀产生,向沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2g;证明该白色沉淀中一定AgNO2. AgNO2和盐酸反应产生AgCl和HNO2。HNO2不稳定极易分解,其化学方程式为:2HNO2=H2O+NO2↑+NO↑。所以原溶液中一定含有NO2-离子。则一定不含H+。②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0g,该沉淀能溶于稀盐酸产生无色气体;则证明白色沉淀是CaCO3,原溶液中一定含有CO32-离子;一定不含有Mg2+; m(CaCO3)="2.0g" , n(CO32-)=(2.0÷100)mol=0.02mol.产生的气体中含有CO2,这说明①产生的沉淀中含有Ag2CO3。原溶液含有的CO32-离子的物质的量为0.04mol.根据碳原子守恒n(Ag2CO3)= n(CO32-)="0.02mol." 11.68g白色沉淀中含有AgNO2的质量为:11.68-0.02mol×276g/mol=6.16g.故n(NO2-)=6.16g÷154g/mol=0.04mol.则原溶液中含有NO2-的物质的量为:n(NO2-)="0.08mol." ③第二份加入过量浓NaOH溶液,加热产生的气体一定为为NH3,因此原溶液中一定NH4+。含有使产生的气体全部放出,用100mL0.5mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。n(H2SO4)=0.05mol,n(NH3)=0.1mol.则原溶液中含有的NH4+的物质的量为0.2mol.所以原溶液中确定含有NH4+、NO2-、CO32-,且物质的量之比为0.2:0.08:0.04=5︰2︰1.所以AB正确。根据电荷守恒,原溶液一定含有NO3-,但K+不能确定。所以C错误。实验过程中产生的NO是无色气体,遇到空气和空气中的氧气反应产生红棕色的NO2气体。故颜色逐渐加深。D正确。所以不正确的选项为:C。
考点:考查离子共存、离子鉴定的知识。


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:单选题
下列离子方程式中,正确的是
| A.稀硫酸滴在铁片上:2Fe + 6H+=2Fe3+ + 3H2 |
| B.氧化镁与稀盐酸混合:MgO + 2H+=Mg2+ + H2O |
| C.铜片插入硝酸银溶液中:Cu + Ag+=Cu2+ + Ag |
| D.氯气通人水中:Cl2+H2O=2H++Cl-+ Cl0- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图,将2 mL浓度为6 mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失。对该反应过程的推断不合理的是: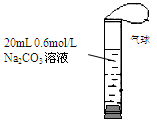
| A.有反应CO32- + 2H+ → CO2↑ + H2O发生 |
| B.有反应CO32- + H+ → HCO3-发生 |
| C.有反应CO32- + CO2 + H2O→ 2HCO3-发生 |
| D.加快盐酸注入速度不会改变反应现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表示对应反应的离子方程式正确的是
| A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+=I2+2H2O |
| B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
C.用惰性电极电解氯化镁溶液:2Cl—+2H2O H2↑+Cl2↑ +2OH— H2↑+Cl2↑ +2OH— |
D.碳酸氢钠的水解:HCO3—+H2O CO32— +H3O+ CO32— +H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变黄的溶液中:Na+、K+、SO42-、Al3+ |
| B.pH=2的溶液中:Na+、ClO-、NH4+、SO42- |
| C.某透明澄清的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D.0.1 mol·L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知SO32-的还原性大于I-,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍无色,则下列关于溶液组成的判断正确的是
① 肯定不含I- ② 肯定不含Cu2+ ③ 肯定含有SO32- ④ 可能含有I-
| A.①③ | B.①②③ | C.③④ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
A.碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同
B.反应N2H4(I)=N2(g)+2H2(g)是一个△S>0的反应
C.40g金刚砂(SiC)中含有C—Si键的个数为2NA(NA为阿伏加德罗常数)
D.HClO是弱酸,所以NaClO是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式错误的是( )
| A.小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-=CO32-+H2O |
| B.澄清石灰水中通入过量的CO2:CO2+OH―=HCO3― |
| C.Cl2与水反应生成盐酸和次氯酸Cl2+H2O=H++Cl―+HClO |
| D.向氯化铝溶液中加入足量氨水:Al3++4NH3·H2O=AlO2―+2H2O +4NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应的离子方程式书写正确的是
| A.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
B.以石墨作电极电解CuCl2溶液:2Cl-+2H2O  2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.铜跟浓硝酸反应:Cu+4HNO3(浓)= Cu2++2NO3-+2NO↑+2H2O |
| D.NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com