
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥简单离子半径由大到小的顺序为_________________________。
(2)⑦、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)由表中①④元素的原子按1:1组成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)____________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
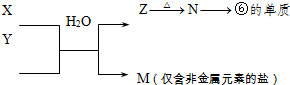
(4)下图中 A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:

I.若B为黄色固体,A为原子半径最小的原子组成的单质,C为双原子分子组成的单质,E能使品红溶液褪色。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
II.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
(共13分)
(1)O2- > Na+> Al3+(2分)
(2)HClO4 > H2SO4 > H2SiO3(2分)
(3) a、b(2分)
(4)I.①  (2分)
(2分)
② 2 : 1(2分)
II.① b、c (2分)
②4OH--4e-= 2H2O+O2↑(1分)
【解析】
试题分析:⑴O2- 、 Na+、 Al3+具有相同的电子排布,原子序数大的离子半径小,则的半径小,答案为:O2- >
Na+> Al3+ ⑵因非金属性Cl>S>Si,则最高价含氧酸的酸性由强到弱的顺序为HClO4>H2SO4>H2SiO3,
故答案为:HClO4>H2SO4>H2SiO3 ⑶①与④组成H2O2,其分解可用MnO2、FeCl3等作催化剂,故答案:a、b;⑷I.若B为黄色固体,是S,A为原子半径最小的原子组成的单质H2,C为双原子分子组成的单质O2,SO2能使品红溶液褪色,F为H2O,①电子式为: ;H2+S
;H2+S H2S,S+O2
H2S,S+O2 SO2,2H2S+SO2=3S+2H2O,生成3molS,要1molSO2,2H2S,即②H2和O2的比为2:1;答案:①F电子式为:
SO2,2H2S+SO2=3S+2H2O,生成3molS,要1molSO2,2H2S,即②H2和O2的比为2:1;答案:①F电子式为: ;②H2和O2的比为2:1;
;②H2和O2的比为2:1;
II.D为淡黄色固体,焰色反应为黄色,D为Na2O2,组成C的元素的原子最外层电子数是内层电子数的2倍,为C。B为O2,A为Na,E为CO2,F为Na2CO3,① D为Na2O2,a、不正确,2Na2O2+2H2O=4NaOH+O2↑,b、正确,-1价的氧化合价可能升高,也可能降低;c、正确,Na+与O22―之间是离子键,两个氧原子之间形成非极性共价键;d、不正确,Na2O2 与酸反应生成盐和水外还有氧气。答案:b c 。②用惰性电极将Na2CO3的饱和溶液进行电解,实质上是电解水,则阳极反应式是4OH--4e-= 2H2O+O2↑,答案:4OH--4e-= 2H2O+O2↑。
考点 :元素周期表、元素及其化合物


科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||





查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |


查看答案和解析>>
科目:高中化学 来源: 题型:
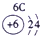
| 第一周期 | 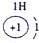 |
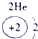 | ||||||
| 第二周期 | 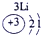 |
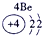 |
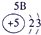 |
 |
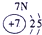 |
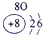 |
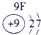 |
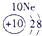 |
| 第三周期 | 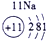 |
 |
 |
 |
 |
 | ||
 表示的是
表示的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com