
| 实验编号 | 实验步骤 | 实验现象 |
| ① | 加入AgNO3溶液 | 有沉淀产生 |
| ② | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ③ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A、一定不存在的离子:Ca2+、Cl- |
| B、c(K+)=0.2 mol/L |
| C、c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
| D、一定存在的离子:K+、NH4+、CO32-、SO42- |
| 0.896L |
| 22.4L/mol |
| 0.896L |
| 22.4L/mol |
| 2.33g |
| 233g/mol |
| 3.94g |
| 197g/mol |


科目:高中化学 来源: 题型:
| A、熔点:SiI4<SiBr4<SiCl4<SiF4 |
| B、沸点:H2S>H2O>HF>NH3 |
| C、熔点:金刚石>晶体硅>晶体锗>硫 |
| D、硬度:金刚石>白磷>冰>水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
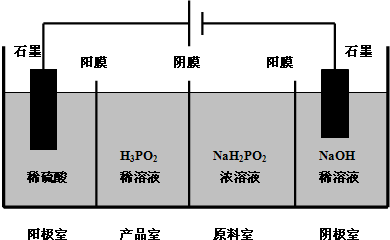 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性 HClO4>HBrO4>HIO4 |
| B、碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 |
| C、稳定性 HCl>H2S>PH3 |
| D、氧化性 I>Br>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆增大的倍数 |
| C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆减小的倍数 |
| D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com