
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为 。
(2)用水洗涤时,如何证明S042-己除尽 。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 。
(4)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
。
(1)Fe2+ + S2O32-+S+H2O  FeS2↓+2H+ + SO42-
FeS2↓+2H+ + SO42-
(2)取少许最后一次洗涤滤液,先用足量盐酸酸化,再向上述清液中滴加BaCl2溶液,若不出现白色浑浊,表示已洗涤干净
(3)4FeS2(s) +11O2(g) = 2Fe2O3(s) + 8SO2(g) △H=-3408kJ·mol-1
[或FeS2(s) +11/4O2(g) = 1/2Fe2O3(s) + 2SO2(g) △H=-852kJ·mol-1]
(4)解:120n(FeS2)+88n(FeS) =1.1200
n(FeS2)+ n(FeS) =2×0.8000g/160g·mol-1
n(FeS2)=0.0075mol
ω(FeS2)= 0.0075mol×120g·mol-1/1.1200g≈0.8036
【解析】
试题分析:(1)由题中信息可写出四种反应物,再由元素守恒和电荷守恒写出产物,Na2S2O3中一个S显+6价,一个S显-2价,其中-2的S与单质S发生归中反应,根据得失电子守恒配出反应。(2)检验SO42 -,需要先用HCl去除干扰离子,以防生成除BaSO4以外的钡盐沉淀。(3)0.01mol FeS2完全燃烧放出8.52KJ的热量。写热化学方程式要标注物质的状态,同时H应与化学计量系数成比例。(4)由质量关系,列出120n(FeS2)+88n(FeS) =1.1200,由铁守恒列出n(FeS2)+ n(FeS) =2×0.8000g/160,联合解得FeS2的量,进而求出含量。
考点:氧化还原反应、电化学基础知识


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三12月联考化学试卷 题型:填空题
(8分)辉铜矿(主成份为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。
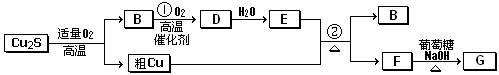
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式__________________________
______其中氧化剂为____________________。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯粗,在该电解反应中阳极物质是 ,电解质溶液是 ;
(4)自然界中当胆矾矿与黄铁矿(FeS2二硫化亚铁)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+ 5FeS2 +12H2O==7Cu2S+5FeSO4+12H2SO4
被氧化的硫和被还原的硫的质量比为_________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com