
【题目】A和B是短周期元素,A2-和B+的核外电子总数之差为8,A的原子序数大于B,下列说法中正确的是( )
A. A和B的原子序数之差为8
B. A和B原子最外层电子数之和为8
C. A和B原子最外层电子数之和为3
D. A、B原子核外电子数总和可能为11
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】已知:(Ⅰ)A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平。
(Ⅱ)2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
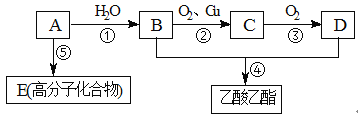
回答下列问题:
(1) 写出A的结构式 。
(2) B、D所含官能团的名称分别是 和 。
(3) 写出下列反应方程式及反应类型:
①方程式 ,反应类型 。
②方程式 ,反应类型 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列说法正确的是( )
A.氮的固定是指将气态氮气变为固态
B.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C.金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属”
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
(1)写出上述制备小苏打的化学方程式。____________________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是__________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是____________________________。
滤渣的主要成分是_________________、_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。
实验中所需的定量仪器除电子天平外,还有__________________。
样品中NaHCO3的质量分数为__________________。(保留1位小数)
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果______________。(选填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废液中含有Cu2+、Mg2+、Zn2+等离子,为将其回收利用,再采用了如下工艺
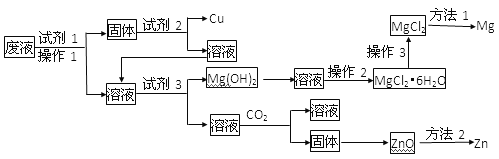
已知Zn(OH)2的性质与Al(OH)3相似
所用试剂在下列试剂中选择
① 铁粉 ②锌粉 ③稀HNO3 ④稀H2SO4 ⑤稀HCl ⑥稀氨水 ⑦NaOH溶液 ⑧石灰水
请回答下列问题:
(1)试剂1、试剂2、试剂3分别可以是________、________、________(填编号)
(2)操作2是_______________、______________、______________
(3)操作3是________________________________
(4)加过量CO2时发生反应的离子方程式________________________
(5)用离子方程式解释试剂3能分离出Mg(OH)2的原理:__________________、_________________
(6)在金属冶炼方法中方法1是_________方法2是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A、CH3COOH溶液与Zn反应放出H2
B、0.1mol/LCH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol/LCH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为___________;滤渣I的主要成分为____________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣II的主要成分为___________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是___________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是____________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氯化铝与过量氨水:Al3+ +4OH-=AlO2- +H2O
B.钠和冷水反应:Na+2H2O =Na++2OH+H2↑
C.氯气与水反应Cl2+H2O![]() Cl- + H++HClO
Cl- + H++HClO
D.碳酸钙与盐酸反应:CO32-+ 2H+ = H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com