
【题目】煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
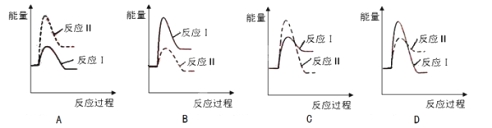
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
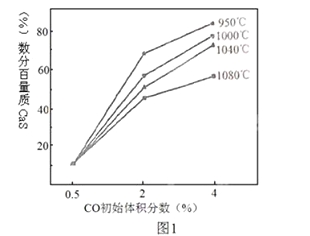
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
/span>
【答案】
Ⅰ、(1)2OH-+SO2═SO32-+H2O;
(2)①酸;溶液中存在HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,显酸性是因其电离大于其水解;②bc;
H2SO3+OH-,显酸性是因其电离大于其水解;②bc;
Ⅱ、(1)3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)△H=1049.2kJmol-1;
(2)![]() ;(3)B;(4)AB。
;(3)B;(4)AB。
【解析】
试题分析:Ⅰ、(1)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(2)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3-![]() SO32-+H+; HSO3-+H2O
SO32-+H+; HSO3-+H2O![]() H2SO3+OH-电离程度大于水解程度,溶液显酸性,故答案为:酸;溶液中存在HSO3-
H2SO3+OH-电离程度大于水解程度,溶液显酸性,故答案为:酸;溶液中存在HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,显酸性是因其电离大于其水解;
H2SO3+OH-,显酸性是因其电离大于其水解;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,a.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故a错误;b.SO32-+H2O![]() HSO3-+OH-,HSO3-
HSO3-+OH-,HSO3-![]() H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;c.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故c正确;故答案为:bc;
H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;c.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故c正确;故答案为:bc;
Ⅱ、(1)CaSO4 (s)+CO (g) ![]() CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJmol-1(反应Ⅰ),CaSO4(s)+4CO(g)
CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJmol-1(反应Ⅰ),CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g)△H2=-175.6kJmol-1 (反应Ⅱ)根据盖斯定律将反应Ⅰ×4-反应Ⅱ)得:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1,故答案为:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1;
CaS(s)+4CO2(g)△H2=-175.6kJmol-1 (反应Ⅱ)根据盖斯定律将反应Ⅰ×4-反应Ⅱ)得:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1,故答案为:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1;
(2)由题意可知,平衡常数等于气体生成物二氧化硫、二氧化碳浓度幂之积除以气体反应物一氧化氮浓度幂之积,所以反应Ⅰ的Kp=![]() ,故答案为:
,故答案为:![]() ;
;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较小,则C错误、B正确,故答案为:B;
(4)A.向该反应体系中投入生灰石,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,故A正确;B.由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,则应在合适的温度区间内控制较低的反应温度,故B正确;C.由图象可知,降低CO的初始体积百分数,减小CaS的质量分数,增加二氧化硫的排放,故C错误;D.提高反应体系的温度,不利于二氧化硫的减少,故D错误;故答案为:AB。


科目:高中化学 来源: 题型:
【题目】下列反应中.反应后固体的质量—定增加的是
A. MnO2中加入H2O2溶液 B. 高温加热C与SiO2混合粉末
C. 加热Na2O2与NaHCO3的混合物 D. Cu丝插入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
 .
.
(1)①仪器c的名称是_________________。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________(选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2 3H2O和SOC12发生反应的化学方程式是________________。
(3)装置B的作用是________________。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2 3H2O的实验方案如下:
![]()
己知几种离子生成氢氧化物沉淀的pH如下表
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是_____________。
②请补充完整由溶液I制备Cu(NO3)2 3H2O晶体的实验方案:
向溶液I中加入__________,冰水洗涤得到Cu(NO3)2 3H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A. c(SO42-)>c(NH4+)>c(H+)=c(OH-) B. c(NH4+)=2c(SO42-)
C. c(NH4+)+c(NH3·H2O)=2c(SO42-) D. c(OH-)+c(SO42-)=c(H+)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业上以天然气、空气为原料合成氨的一种工艺流程:

(1)脱硫反应第一步是利用Fe(OH)3除去H2S,该反应的化学方程式是____________。
(2)脱硫反应第二步是利用空气氧化回收硫,该反应中氧化剂与还原剂的物质的量之比为_________,下列试剂中也适宜作此反应的氧化剂的是________(填选项)。
A.Cl2 B.H2O2 C.KMnO4 D.O3
(3)流程中Fe(OH)3和K2CO3可循环利用,你认为流程中还可循环利用的物质有_______。
(4)合成氨反应的原料气中V(N2)∶V(H2)=1∶3。平衡混合物中氨的含量与温度、压强的关系如下图所示:

则A、B、C三点对应的化学平衡常数KA、KB、KC的关系是___________(用“>”、“<”或“=”表示);A点H2的平衡转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学知识用数轴表示能体现出形象直观、简明易记的特点,下列用数轴表示不合理的是
A. 平衡常数与转化率关系: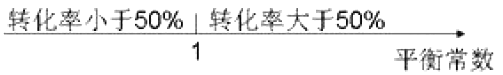
B. 向烧碱液中通入SO2后的产物: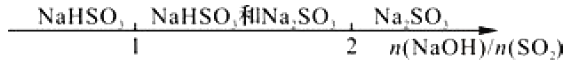
C. 铁和稀硝酸反应: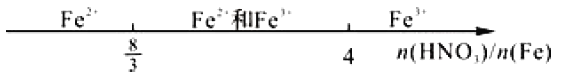
D. 向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: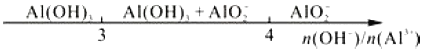
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 共价化合物中可能含有离子键
B. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C. 离子化合物中只含有离子键
D. 离子化合物在熔融状态下能电离出自由移动的离子,而共价化合物不能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com