
【题目】某元素最高价氧化物对应水化物的化学式是H3XO4 , 这种元素的气态氢化物的分子式为( )
A.HX
B.XH3
C.H2X
D.XH4
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 合成纤维和人造纤维可统称为化学纤维
B. 酚醛树脂和聚氯乙烯都是热固性塑料
C. 锦纶丝接近火焰时先蜷缩,灰烬为有光泽的硬块
D. 复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性能超过了单一材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届湖南省长沙市长郡中学高三第一次模拟】
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
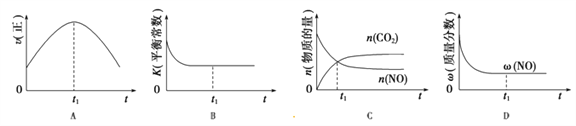
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
② 写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
③ 上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
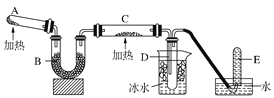
(1)试管A中发生反应的化学方程式是_______________________;
(2)装置B中烧瓶内试剂可选用__(填序号);
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.无水氯化钙
(3)装置C中盛装的物质是___________;实验时在C中观察到的现象是_______;
(4)C中发生的化学反应方程式是________________;
(5)请简述实验室如何验满氨气____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,______与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_________________________。
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由。_____________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(4)仪器B的名称为_______,干燥管D的作用为___________。
(5)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
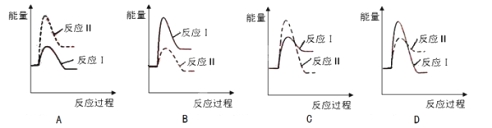
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
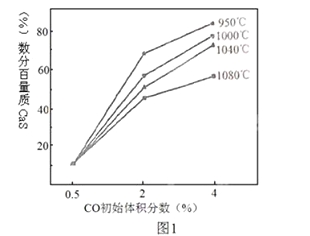
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
/span>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。科学家尝试用Na2SeO3消除人体内的活性氧,则在此过程中Na2SeO3的作用是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.以上均不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用或事实与胶体的性质没有关系的是
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com