
【题目】已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且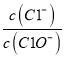 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 某温度下,若反应后溶液中n(ClO-)=1mol ,n(C1O3-)=2mol,则n(C1-)= 11 mol
B. 参加反应的氯气的物质的量等于0.5amol
C. 上述反应中转移电子的物质的量至少为0.5amol
D. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
【答案】D
【解析】A、若某温度下,若反应后溶液中n(ClO-)=1mol ,n(C1O3-)=2mol,根据氧化还原反应中电子转移数目相等可知1×n(C1-)=1×1+5×2,n(C1-)=11mol,选项A正确;B、在反应后产物中K与Cl原子个数比为1:1,因为n(KOH)=amol,所以参加反应的氯气的物质的量等于0.5amol,选项B正确;C、改变温度,若反应后产物完全是KCl、KClO,发生反应:Cl2+2KOH=KCl+KClO+H2O则转移电子的物质的量是0.5amol,则转移电子的物质的量至少为0.5amol,选项C正确。D、改变温度,若完全转化为产物KC1O3,发生反应:3Cl2+6KOH=5KCl+ KClO3+3H2O,则转移电子的物质的量是![]() amol,达到最大值,最大理论产量为
amol,达到最大值,最大理论产量为![]() amol,选项D错误。答案选D。
amol,选项D错误。答案选D。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列反应中既属于化合反应,又属于氧化还原反应的是( )
A. SO2+H2O2=H2SO4B. Zn+2AgNO3=Zn(NO3) 2+2Ag
C. 2HClO=2HCl+O2↑D. CO2+2NaOH=Na2CO3+H2 O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是工业上常用的化工原料,可以用于合成安息香酸苄酯和高分化合物G (部分反应条件略去),流程如下所示,请回答下列问题:
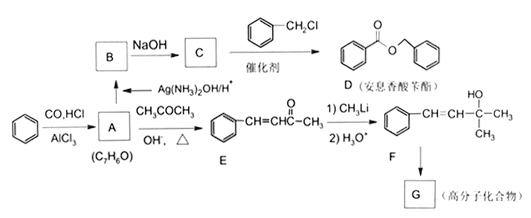
(1)C的化学名称是____________,B中的官能团名称是____________。
(2)E分子中最多有____________个原子共平面;G的结构简式为____________;
(3)C生成D的反应类型为____________。
(4)A生成E的化学方程式为_____________________________________。
(5)H是D的同分异构体,分子中含有酯基,有两个苯环且不直接相连,符合上述条件的结构有____________种,其中核磁共振氢谱图有6组峰,且面积比为3∶2∶2∶2∶2∶1的同分异构体的结构简式为____________(写出一种即可)。
(6)参照上述合成路线,以2-氯丙烷为原料,其它无机试剂和有机溶剂任选,设计2-甲基-2-丙醇的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸乙酯为允许使用的食用香料,又称蚁酸乙酯,有辛辣的刺激味和菠萝样的果香香气,还有强烈朗姆酒似香气,并略带苦味。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点如下
试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |
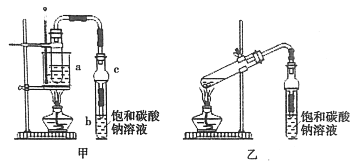
(1)制备粗品
将4mL乙醇、3mL甲酸和2mL浓硫酸加入试管a中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管b内得到甲酸乙酯的粗品。
①实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是__________;浓硫酸用量又不能过多,原因是_________。
②球形干燥管C的作用是__________。
③若用乙装置制备甲酸乙酯,其缺点有__________。
(2)制备精品
①反应结束后,从试管b中分离出甲酸乙酯粗品所用的主要仪器__________。
②从b中分离出的甲酸乙酯中常含有少量的乙醇、乙醚和水,应先加入无水氯化钙,除去______,然后再通过_________操作得到甲酸乙酯。
③某同学用装有饱和氢氧化钠的试管收集甲酸乙酯,几乎没有收集到产物。原因是______________(用化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于O2和SO2两种气体的叙述,正确的是( )
A.两者质量相等时,其分子数相等
B.两者质量相等时,其原子数相等
C.同温同压时,两者密度之比为1∶2
D.同温同压时,同体积气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次递增。A、E同主族,B、D同周期,且B和D最外层电子数之和为10;A与D可形成A2D、A2D2共价化合物。请回答下列问题。
(1)D位于周期表第_____________周期第_____________族;
(2)E离子的结构示意图为_____________;与E同周期的元素中,金属性最弱的金属元素名称是___________,最稳定的气态氢化物的化学式为_____________;
(3)C2的电子式为_____________,B与D通常能形成_____________(填“离子”或“共价”)化合物,在E2D2中含有的化学键有__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA 表示阿伏加德罗常数,下列说法正确的是
A. T ℃时,1 L pH=6纯水中,含10-8NA个![]()
B. 15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA
C. 1 mol SiO2中含有2 mol Si–O单键
D. 14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉、淀粉酶、控制淀粉酶合成的遗传物质,它们的基本单位是 ( )
A. 葡萄糖、蛋白质、DNA B. 蔗糖、氨基酸、核糖核苷酸
C. 葡萄糖 、氨基酸、脱氧核苷酸 D. 麦芽糖、多肽、核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡产生;烧杯中可观察到白色沉淀生成。
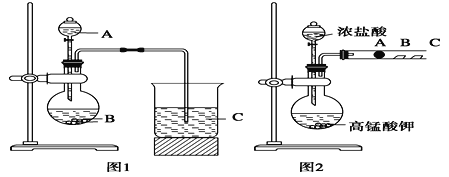
(1)写出选用的物质:A_________,B_________,C_________(填化学式);
(2)乙同学认为甲同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该装置中应盛放___________。(填试剂)
(3)烧杯中反应的离子方程式为___________________________________。
(4)丙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr 溶液的棉花、湿润淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。A处的实验现象为:_____________;写出B处反应的离子方程式___________。
(5)丙同学的实验不能充分证明氧化性:Cl2>Br2>I2,理由是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com