
【题目】一定温度下的恒容密闭容器中,可逆反应2NO2(g)![]() 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
【答案】A
【解析】
试题①2V(O2)=V(NO2),未指明正逆反应,不能判断为平衡状态,错误; ②单位时间内生成n molO2的同时生成2n molNO2,符合正逆反应速率相等,为平衡状态,正确;③NO2、NO、O2的浓度之比为2∶2∶1时,不一定是平衡状态,错误; ④混合气体的颜色不再改变的状态,应为二氧化氮为红棕色气体,达到平衡时,气体颜色不再变化,正确;⑤混合气体的密度不再改变的状态不一定是平衡状态,应为容器的体积不变,则气体的密度始终不变,错误;⑥该反应是气体的物质的量发生变化的可逆反应,混合气体的平均相对分子质量发生变化,平衡时混合气体的平均相对分子质量不再改变,正确,答案选A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.没有单质参加的化合反应也可能是氧化还原反应
B.凡有单质生成的化学反应一定是氧化还原反应
C.阳离子只能得电子被还原,阴离子只能失电子被氧化
D.氧化剂本身被还原,生成氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子序数依次减小且三者原子序数之和为16,其常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是
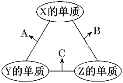
A. X元素位于ⅥA族
B. 1 mol Y和3 mol Z在一定条件下充分反应生成2 mol C
C. A和C在一定条件下能发生氧化还原反应
D. C和X一定条件下能反应生成A和B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质(A、B、C、D)的物质的量变化如图M所示,对该反应的推断合理的是( ) 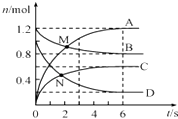
A.M点表示v(A)=v(B)
B.0~6s内,v(A):v(B):v(C):v(D)=3:1:1.5:2
C.反应进行到6s时,各物质的物质的量浓度相等
D.反应进行到6s时,C的平均反应速率为 0.1molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是
A.C (s) +1/2O2 (g) = CO(g) ΔH=-393kJ·molˉ1
B.C + O2 = CO2 ΔH=-393kJ·molˉ1
C.C (s) + O2 (g)=CO2 (g) ΔH=+393kJ·molˉ1
D.C(s)+O2(g)=CO2(g) ΔH=-393kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等.下列各混合物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 .
(2)除去食盐溶液中的水 .
(3)淡化海水 .
(4)除去KC1固体中含有的少量KClO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是
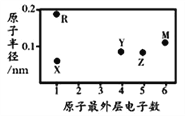
A. 简单阳离子半径:X
B. M的氢化物常温常压下为气体,分子间无氢键
C. 最高价氧化物的水化物的酸性:Z<Y
D. X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1molL﹣1的四种溶液: ①Na2CO3②NaHCO3③HCl ④NH3H2O
(1)有人称溶液①是油污的“清道夫”,原因是(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)
(3)向④中加入少量氯化铵固体,此时 ![]() 的值(填“增大”“减小”或“不变”).
的值(填“增大”“减小”或“不变”).
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3H2O]=molL﹣1(填数值);此时溶液中离子浓度的大小顺序是:;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积④的体积(填“大于”小于”或“等于”)
(5)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的c( H+)= molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
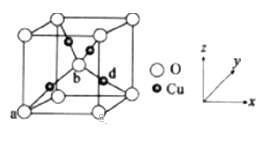
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com