
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是
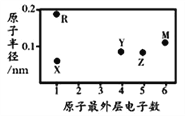
A. 简单阳离子半径:X
B. M的氢化物常温常压下为气体,分子间无氢键
C. 最高价氧化物的水化物的酸性:Z<Y
D. X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
【答案】C
【解析】X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为IA族元素,Y最外层有4个电子,位于IVA族,Z原子最外层有5个电子位于VA族,M子最外层有6电子位于VIA族;R的原子半径最大,是Na元素;X的原子半径最小是H元素;Y和Z的原子半径接近,M原子半径大于Y而最外层电子数大于Y,所以Y是C,Z是N,M是S元素。A、离子半径H++,电子层数越多,离子半径越大,故A正确;B、S的氢化物为H2S,常温常压下为气体,分子间无氢键,故B正确;C、元素的非金属性越强,其最高价含氧酸酸性越强,非金属性N>C,所以最高价含氧酸酸性HNO3>H2CO3,故C错误;C和H可以形成C6H6、C2H4均为平面结构,分子中存在极性共价键和非极性共价键,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是 ( )
A.胶体是呈黏胶状的物质
B.胶体的外观不透明、不均匀
C.利用半透膜可以除去AgI胶体中的KNO3
D.利用滤纸可以过滤除去蛋白质胶体中的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀作为一种新兴材料日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3BeO.Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
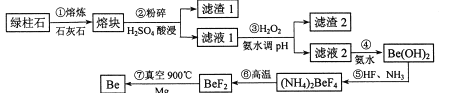
按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:

(1)步骤②中将熔块粉碎的目的是_____________;滤渣1的主要成分是________。
(2)步骤③加入H2O2时发生反应的离子方程式为__________,从滤液1中得到沉淀的合理pH为__________(填序号)。
A 3.3-3.7 8 3.7—5.0 C 5.0~5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是_____________。从溶液中得到(NH4)2BeF4的实验操作是_______、过滤、洗涤、干燥。
(4)步骤⑥的反应类型是_______,步骤⑦需要隔绝空气的环境,其原因是_____________。
(5)若绿柱石中Be0的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金_______t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,可逆反应2NO2(g)![]() 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化曲线如下图所示,按要求解决下列问题。

(1)该反应的化学方程式为:_________________________________;
(2)用A表示的反应速率为:___________________;
(3)下列条件改变时,能加快化学反应速率的是_________请填代号)
A.扩大容器的容积 B.增大C的用量
C.降低体系的温度 D.加入催化剂
(4)该反应达到化学反应限度时,B的转化率为____________。(请保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子的吸收光谱是线状的而不是连续的,主要原因是( )
A. 原子中电子的能量高低 B. 外界条件的影响
C. 原子轨道的能量是量子化的 D. 仪器设备的工作原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示装置: 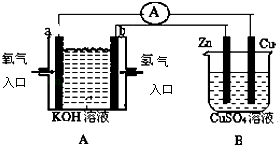
(1)装置A中b为极,电极反应式为;
(2)B装置中Cu为极,电极反应式为;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E的原子序数依次增大,其中E不属于短周期元素,常见单质分子B2中含有3对共用电子对,D的最外层电子数是周期序数的2倍,E单质是一种紫红色金属,甲、乙、丙是上述部分元素组成的二元化合物.且乙、丙分子所含电子总数相同,转化关系如图所示,其中甲是黑色固体,丙是一种常见的无色液体。下列说法不正确的是
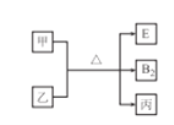
A. 乙分子中共用电子对数目与B2分子相同
B. 单质D与E在加热时可生成1:1型化合物
C. 原子半径:B>C
D. C与D位于同一主族,与B位于同一周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com