
【题目】有如图所示装置: 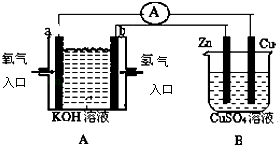
(1)装置A中b为极,电极反应式为;
(2)B装置中Cu为极,电极反应式为;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为 L.
【答案】
(1)负; H2﹣2e﹣+2OH﹣=2H2O
(2)阳; Cu﹣2e﹣=Cu2+
(3)2.24
【解析】解:(1)装置A为原电池a为正极,氧气得到电子生成氢氧根离子,电极反应为;O2+2H2O+4e﹣=4OH﹣,b为负极,氢气失电子在碱溶液中生成水,电极反应为H2﹣2e﹣+2OH﹣=2H2O,所以答案是:负;H2﹣2e﹣+2OH﹣=2H2O;(2)B装置为电解池,铜电极做电解池的阳极,铜失电子生成铜离子,电极反应Cu﹣2e﹣=Cu2+,所以答案是:阳;Cu﹣2e﹣=Cu2+;(3)当铜片的质量变化为12.8g时物质的量= ![]() =0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为;O2+2H2O+4e﹣=4OH﹣,依据电子守恒得到,O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,所以答案是:2.24.
=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为;O2+2H2O+4e﹣=4OH﹣,依据电子守恒得到,O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,所以答案是:2.24.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是
A.C (s) +1/2O2 (g) = CO(g) ΔH=-393kJ·molˉ1
B.C + O2 = CO2 ΔH=-393kJ·molˉ1
C.C (s) + O2 (g)=CO2 (g) ΔH=+393kJ·molˉ1
D.C(s)+O2(g)=CO2(g) ΔH=-393kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是
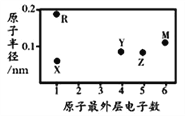
A. 简单阳离子半径:X
B. M的氢化物常温常压下为气体,分子间无氢键
C. 最高价氧化物的水化物的酸性:Z<Y
D. X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响图象如下,下列判断正确的是( ) 
A.由图1可知,T1<T2 , 该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1molL﹣1的四种溶液: ①Na2CO3②NaHCO3③HCl ④NH3H2O
(1)有人称溶液①是油污的“清道夫”,原因是(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)
(3)向④中加入少量氯化铵固体,此时 ![]() 的值(填“增大”“减小”或“不变”).
的值(填“增大”“减小”或“不变”).
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3H2O]=molL﹣1(填数值);此时溶液中离子浓度的大小顺序是:;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积④的体积(填“大于”小于”或“等于”)
(5)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的c( H+)= molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.H2SO4═H22++SO42﹣
B.NaHCO3═Na++H++CO32﹣
C.NaOH═Na++O2﹣+H+
D.Na2SO4═2Na++SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com