
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
【答案】
(1)![]()
(2)吸热
(3)bc
(4)830
【解析】解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,
;(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,
所以答案是:吸热;(3)a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故d错误.
故选bc;(4)平衡浓度符合下式c(CO2)c(CH2)=c(CO)c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只受温度的影响,当K=1时,根据表中数据,所以温度是830℃,
所以答案是:830.
【考点精析】解答此题的关键在于理解化学平衡常数的含义的相关知识,掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态,以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】下列热化学式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJmol﹣1
B.500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g) ![]() 2NH3(g)△H=﹣38.6 kJmol﹣1
2NH3(g)△H=﹣38.6 kJmol﹣1
C.稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJmol﹣1
D.1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图)。诸回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_____棒;乙池中的____棒。
②在乙池中阳极的电极反应是____________。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中总反应的离子方程式:___________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是 ( )
A.胶体是呈黏胶状的物质
B.胶体的外观不透明、不均匀
C.利用半透膜可以除去AgI胶体中的KNO3
D.利用滤纸可以过滤除去蛋白质胶体中的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 含有金属阳离子的晶体一定是离子晶体
D. 元素的非金属性越强,其单质的活泼性一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的硫酸亚铁、较多的Cu2+和较少的Na+以及部分泥沙.为了减少污染并变废为宝,工厂计划从该废水中回收绿矾和金属铜.请根据如图流程图完成实验方案.

(1)操作1的名称___________.所需的玻璃仪器有_____________________
(2)已知试剂1为Fe,试剂2为稀硫酸,则滤渣2所含物质的化学式为__________
(3)在澄清溶液中加入试剂1后发生化学反应,请写出该反应的离子方程式____________.
(4)滤渣1中加入试剂2后发生化学反应,请写出该反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀作为一种新兴材料日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3BeO.Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
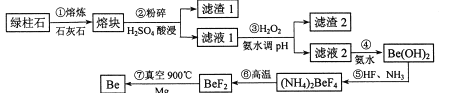
按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:

(1)步骤②中将熔块粉碎的目的是_____________;滤渣1的主要成分是________。
(2)步骤③加入H2O2时发生反应的离子方程式为__________,从滤液1中得到沉淀的合理pH为__________(填序号)。
A 3.3-3.7 8 3.7—5.0 C 5.0~5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是_____________。从溶液中得到(NH4)2BeF4的实验操作是_______、过滤、洗涤、干燥。
(4)步骤⑥的反应类型是_______,步骤⑦需要隔绝空气的环境,其原因是_____________。
(5)若绿柱石中Be0的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金_______t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示装置: 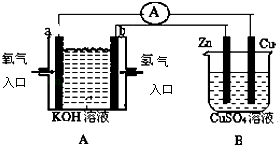
(1)装置A中b为极,电极反应式为;
(2)B装置中Cu为极,电极反应式为;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为 L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com