
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
【答案】 p 5s25p4 6 球形 O>Cl>C 平面三角形 sp2、sp3 l3NA(或13×6.02×1023) H2O BC 8 ![]()
【解析】(1)Te与O是同一主族元素,属于元素周期表中p区元素,Te为第5周期第ⅥA族元素,其基态原子的价电子排布式为5s25p4,故答案为:p;5s25p4;
(2)基态Na原子的电子排布式为1s22s22p63s1,核外电子占据的原子轨道总数为6,最高能层电子为3s,电子云轮廓图为球形,故答案为:6;球形;
(3)元素的非金属性越强,氧气与氯化氢能够反应生成氯气和水,氧元素的非金属性最强,电负性数值越大,C、O、Cl的电负性由大到小的顺序为O>Cl>C,故答案为:O>Cl>C;
(4)CO32-中C的价层电子对数=3+![]() ×(4+2-3×2)=3,几何构型为平面三角形;根据碳酸丙烯酯的结构简式,则其中碳原子有2种,不饱和的碳氧双键中的C原子采用sp2杂化,饱和的碳原子采用sp3杂化;1mol碳酸丙烯酯中含有6molC-H,4molC-O,2molC-C和1molC=O,共13mol,键的数目为13×6.02×1023,故答案为:平面三角形;sp2、sp3;13×6.02×1023;
×(4+2-3×2)=3,几何构型为平面三角形;根据碳酸丙烯酯的结构简式,则其中碳原子有2种,不饱和的碳氧双键中的C原子采用sp2杂化,饱和的碳原子采用sp3杂化;1mol碳酸丙烯酯中含有6molC-H,4molC-O,2molC-C和1molC=O,共13mol,键的数目为13×6.02×1023,故答案为:平面三角形;sp2、sp3;13×6.02×1023;
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是H2O,该配离子包含的作用力有H-O极性键、配位键,故答案为:BC;
(6)晶胞中Na+离子数目为8,O2-离子数目为8×![]() +6×
+6×![]() =4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,则O的配位数为8;晶胞质量为
=4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,则O的配位数为8;晶胞质量为![]() g,该晶胞的密度为ρgcm-3,而晶胞体积为
g,该晶胞的密度为ρgcm-3,而晶胞体积为![]() g÷ρgcm-3=
g÷ρgcm-3=![]() cm3,晶胞棱长为
cm3,晶胞棱长为 cm,则Na与O之间的最短距离为立方体对角线的
cm,则Na与O之间的最短距离为立方体对角线的![]() =
=![]() ×
×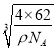 cm,故答案为:8;
cm,故答案为:8; ![]() ×
× 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有如图所示装置: 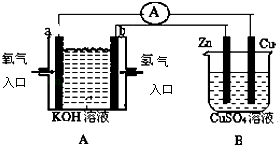
(1)装置A中b为极,电极反应式为;
(2)B装置中Cu为极,电极反应式为;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)

①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E的原子序数依次增大,其中E不属于短周期元素,常见单质分子B2中含有3对共用电子对,D的最外层电子数是周期序数的2倍,E单质是一种紫红色金属,甲、乙、丙是上述部分元素组成的二元化合物.且乙、丙分子所含电子总数相同,转化关系如图所示,其中甲是黑色固体,丙是一种常见的无色液体。下列说法不正确的是
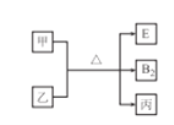
A. 乙分子中共用电子对数目与B2分子相同
B. 单质D与E在加热时可生成1:1型化合物
C. 原子半径:B>C
D. C与D位于同一主族,与B位于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目:高中化学 来源: 题型:
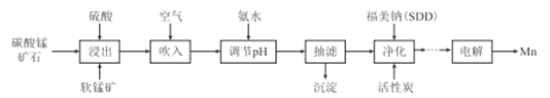
【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
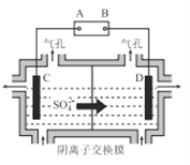
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物H常用作防腐剂,H可利用下列路线合成: 
已知:①A是相对分子质量为92的烃;
②  (﹣R1、﹣R2表示氢原子或烃基);
(﹣R1、﹣R2表示氢原子或烃基);
③ ![]() ;
;
④D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1.
回答下列问题:
(1)A的分子式为 .
(2)同时符合下列条件的E的同分异构体共有种. ①分子中含有苯环 ②能发生银镜反应 ③能与FeCl3溶液发生显色反应
(3)检验F中含氧官能团的试剂为 .
(4)H的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y均为短周期元素,X原子的最外层有2个电子,Y原子的最外层有7个电子,这两种元素形成化合物的化学式是
A. XY B. XY2 C. X2Y D. X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)肼(N2H4)与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的密度为1.92g/L,且其中氮元素的质量分数为0.977,则该反应的化学方程式为____.
(2)二氧化氮在一定条件下,可以发生如下反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
实验编号 | 温度 | 起始物质的量mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 4.0 | 1.0 | 0.9 |
乙 | T2 | 1.0 | 4.0 | 0.8 |
丙 | T2 | 0.4 | 0.6 | a |
①在实验甲中,若2min时测得放出的热量是8.4kJ,0~2min时间内,用SO2表示的平均反应速率v(SO2)=_______________,该温度下的平衡常数为_________。(结果保留到小数点后两位)
②由表中数据可推知:T1_______T2(填“>”“<”或“=”)
③实验丙中,达到平衡时NO2的转化率为______________.
(3)工业上可以用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。室温下测得NH4HSO3溶液pH为6,则溶液的![]() ________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
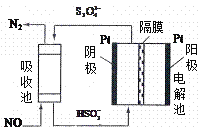
(4)使用间接电化学法可以处理煤烟气中的NO,装置如图,已知电解池溶液的pH在4~7之间,写出阴极的电极反应式__________________。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com