
【题目】下图是实验室制乙酸乙酯的装置。
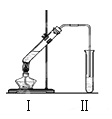
(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是 。
(2)为了证明浓硫酸的作用,某同学进行了以下4个
实验,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3molL﹣1硫酸 | 饱和Na2CO3溶液 | 1.2 |
D | 3mL乙醇、2mL乙酸、6mL6molL﹣1盐酸 | 饱和Na2CO3溶液 | 1.2 |
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴 试液,每次实验结束后可观察到试管Ⅱ中的现象是 ,
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是 、 ;实验D和实验C对照,你又能得出的结论是 。
(3)饱和Na2CO3溶液的作用是____________________、___________。
【答案】29.(1)防止暴沸 (2)① 酚酞; 液体分层,上层呈无色,下层呈红色
② 催化剂、吸水剂;对该反应起催化作用的实际上为H+
(3)降低酯在水中的溶解度,容易分层,除去酯层中混有的酸和醇
【解析】
试题分析:(1)在乙酸乙酯的制备中,加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸。
(2)①饱和碳酸钠溶液是强碱弱酸盐,溶液水解显碱性,滴入酚酞显红色,所以为了更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴酚酞试液,每次实验结束后可观察到试管Ⅱ中的现象是液体分层,上层呈无色,下层呈红色。
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,其它条件相同,不同的是C使用了硫酸,D使用了盐酸,所以可得出的结论是对该反应起催化作用的实际上为H+。
(3)乙酸乙酯在饱和碳酸钠溶液中溶解度很小,且挥发出来的乙酸能与碳酸钠反应,挥发出来的乙醇能溶于碳酸钠溶液,所以饱和Na2CO3溶液的作用是降低酯在水中的溶解度,容易分层,除去酯层中混有的酸和醇。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】将羧酸的碱金属盐电解可生成烃类化合物,例如
2CH3COOK+2H2O=CH3—CH3↑+2CO2↑+H2↑+2KOH
现充分电解CH2ClCOOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
A.CO2气体在阴极放出
B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体物质是KOH
D.混合液蒸干后得到的固体物质是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):


(1)Y的电子式为 ,构成C单质的元素在周期表中位于
(2)反应①的离子方程式为 反应②的离子方程式为
(3)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为: 静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某学生设计了一个实验以证明PbO中含有氧,反应方程式如下:
① PbO + C![]() Pb + CO (主要)
Pb + CO (主要)
② PbO + CO![]() Pb + CO2
Pb + CO2
③〔Cu (NH3 )2〕Ac + CO +NH3![]() 〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
试根据下图回答问题:

(1) 盛澄清石灰水的试管开始一段时间可能没有现象,其原因是 。
(2) 烧杯中醋酸二氨合铜 (〔Cu (NH3 )2〕Ac ) 的作用为 。
(3) 实验后的醋酸二氨合铜经适当处理又可再生,适宜于再生的生产条件是 。(说明;不能加药品仅从生产条件考虑,以节约成本)
Ⅱ、图像分析是化学研究的一种重要的手段。某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出)。请回答:
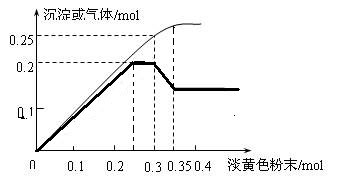
(1)根据图像所示,推测溶液中肯定有_____________离子。(写化学式)
(2)请写出曲线中过氧化钠物质的量在0.3~0.35mol时,粗的曲线出现下滑的现象,请用两个离子反应方程式解释该过程___________________,_________________.
(3)溶液中离子的物质的量之比为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海藻灰中可以提取碘的主要反应为:2 I-+Cl2=2 Cl-+I2,下列说法正确的是)( )
A.该反应属于置换反应 B.I-具有氧化性
C.1mol氯气转移了1mol电子 D.Cl2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法正确的是( )
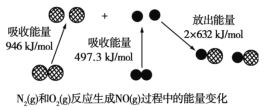
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接反应生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com