
����Ŀ��A��B��C��D��E����ѧ��ѧ�������ʣ� X��Y��Z��M��N��W��H��K�dz��������X��B��C�Ļ��ϲ������֮��������ת����ϵ����Ӧ��Ͳ����е�H2O����ȥ����


��1��Y�ĵ���ʽΪ ������C���ʵ�Ԫ�������ڱ���λ��
��2����Ӧ�������ӷ���ʽΪ ��Ӧ�������ӷ���ʽΪ
��3��ij������B��Ư�ۡ�
��д����Ư�۵Ļ�ѧ����ʽ
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ijС�����������ʵ�飺��ȡƯ��2.0g����ĥ���ܽ⣬������250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ��������������ʱ���������ӷ���ʽΪ�� ���á�����ȫ��Ӧ����0.1mol��L-1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷ�����������Ϊ ��������С�������λ����
���𰸡�(1)![]() ���������ڵ�VIIA�壻
���������ڵ�VIIA�壻
�� 2Cl-+2 H2O ![]() 2OH��+Cl2�� + H2����2Al��2OH��+2 H2O��2AlO
2OH��+Cl2�� + H2����2Al��2OH��+2 H2O��2AlO![]() �� 3H2����
�� 3H2����
��3����2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��
��ClO��+2I��+2H+=I2+Cl��+H2O ������д������CaSO4�����֣���35.75% ��
��������
�������������������3����ȡƯ�����������������������Ƶķ�Ӧ��X��B��C�Ļ���������XΪNaCl��A��CΪ����������AΪH2��CΪCl2��YΪNaOH��NaOH��D��Ӧ����A����DΪAl��WΪHCl��ZΪNaAlO2��KΪAlCl3��MΪAl(OH)3��W��E��Ӧ����H2����EΪ������HΪ�����Ȼ�����H��������Ӧ�����HΪ��۽�������Ϊ����(1)NaOH�ĵ���ʽΪ��![]() ��Cl��17��Ԫ����λ�ڵ������ڵ�VIIA������2����Ӧ���ǵ�ⱥ��ʳ��ˮ�����ӷ�Ӧ����ʽΪ��2Cl�� �� 2H2O
��Cl��17��Ԫ����λ�ڵ������ڵ�VIIA������2����Ӧ���ǵ�ⱥ��ʳ��ˮ�����ӷ�Ӧ����ʽΪ��2Cl�� �� 2H2O![]() Cl2�� �� H2�� �� 2OH������Ӧ������2Al �� 2OH�� �� 2H2O = 2AlO2�� �� 3H2����(3)��Cl2 �� 2Ca(OH)2 = CaCl2 �� Ca(ClO)2 �� H2O��������Ca(ClO)2������������I��������I2�����ݻ��ϼ�������������ƽ��ClO�� �� 2I�� �� 2H �� = I2 �� Cl�� �� H2O��������ϵʽ��ClO�� ��I2��2Na2S2O3��n(ClO��) = 20 �� 10��3 �� 0.1/2mol = 1 �� 10��3mol��Ư�۵���Ч�ɷ���Ca(ClO)2����Ca(ClO)2������������1 �� 10��3 �� 143 �� 250/(25 �� 2)g = 0.715g������������Ϊ0.715/2 �� 100% = 35.75%��
Cl2�� �� H2�� �� 2OH������Ӧ������2Al �� 2OH�� �� 2H2O = 2AlO2�� �� 3H2����(3)��Cl2 �� 2Ca(OH)2 = CaCl2 �� Ca(ClO)2 �� H2O��������Ca(ClO)2������������I��������I2�����ݻ��ϼ�������������ƽ��ClO�� �� 2I�� �� 2H �� = I2 �� Cl�� �� H2O��������ϵʽ��ClO�� ��I2��2Na2S2O3��n(ClO��) = 20 �� 10��3 �� 0.1/2mol = 1 �� 10��3mol��Ư�۵���Ч�ɷ���Ca(ClO)2����Ca(ClO)2������������1 �� 10��3 �� 143 �� 250/(25 �� 2)g = 0.715g������������Ϊ0.715/2 �� 100% = 35.75%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡ����þ������������:��Ũ���ᾧ �������� ������ʯ�������� �����ڵ�⣬��ȷ������˳����
A���٢ڢۢܢ� B���ڢܢۢ٢� C���ݢܢۢ٢� D���ۢܢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����AlCl3��FeCl3�����Һ�У��ȼ��������KI��Һ���ټ���������Na2S��Һ�����õ��ij��������� ��
A��Fe��OH��3��Al��OH��3
B��Al��OH��3��I2
C��Fe2S3��I2
D��FeS��S��Al��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)��O2(g) ![]() 2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�Ħ�H����99 kJ��mol��1��
2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�Ħ�H����99 kJ��mol��1��

��ش��������⣺
��1��ͼ��A��C�ֱ��ʾ________��________��
��2��ͼ�Ц�H��________kJ��mol��1��
��3��V2O5�Ĵ�ѭ����������Ϊ��V2O5����SO2ʱ����������ԭΪ�ļ۷�������ļ۷��������ٱ�����������д���ô�ѭ�������Ļ�ѧ����ʽ�� �� ��
��4����һ�������£������Ϊ2L�������м���2mol O2��3mol SO2���п��淴Ӧ�� 2SO2��g��+O2��g��![]() 2SO3��g����2min����O2�����ʵ���Ϊ1.6mol��������O2��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���V��O2��= ������SO3��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���V��SO3��= ��
2SO3��g����2min����O2�����ʵ���Ϊ1.6mol��������O2��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���V��O2��= ������SO3��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���V��SO3��= ��
��5����֪�������ȼ����Ϊ296 kJ��mol��1��д����S(s)����3 mol SO3(g)���Ȼ�ѧ����ʽ(Ҫ��д���������)��(��֪ȼ������ָ25 �桢101 kPaʱ��1 mol��������ȫȼ�������ȶ��Ļ�����ʱ���ų�������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ����������������װ�á�
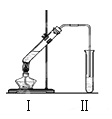
��1������ǰ��ͨ����Ҫ���Թܢ��м������Ƭ��Ŀ���� ��
��2��Ϊ��֤��Ũ��������ã�ijͬѧ����������4��
ʵ�飬ʵ���¼�����
ʵ���� | �Թܢ����Լ� | �Թܢ����Լ� | �л�����/cm |
A | 3mL�Ҵ���2mL���ᡢ1mL18molL��1Ũ���� | ����Na2CO3��Һ | 5.0 |
B | 3mL�Ҵ���2mL���� | ����Na2CO3��Һ | 0.1 |
C | 3mL�Ҵ���2mL���ᡢ6mL3molL��1���� | ����Na2CO3��Һ | 1.2 |
D | 3mL�Ҵ���2mL���ᡢ6mL6molL��1���� | ����Na2CO3��Һ | 1.2 |
��Ϊ���õ��ⶨ����������Ԥ����Na2CO3��Һ�еμ�1�� ��Һ��ÿ��ʵ�������ɹ۲쵽�Թܢ��е������� ��
�ڷ���ʵ��A��B��C�����ݣ����Եó�Ũ�����ڷ�Ӧ�е������� �� ��ʵ��D��ʵ��C���գ������ܵó��Ľ����� ��
��3������Na2CO3��Һ��������____________________��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ����������й㷺����;��ij�о�С��������������ȡ�ߴ�����������
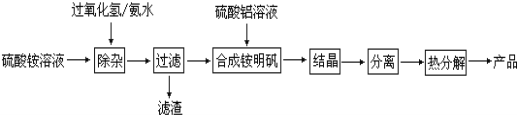
������������ͼ��գ�
��1�������ӡ��������ȼ�����������ַ�Ӧ�����ð�ˮ������Һ��pH��ʹ�������Һ�е�����Fe2+����ΪFe3+����һ��ת��ΪFe(OH)3�Ӷ���ȥFe2+����Fe2+��������������ΪFe3+�����ӷ���ʽΪ: ��
��2��������������Һʱ�����������ữ���ữ��Ŀ���� ��
��3�������롱������������ (����ĸ����)��
A������ B����Һ C������
��4�����������Ļ�ѧʽΪNH4Al(SO4)212H2O����������� (����������)��0.1mol/L�������ˮ��Һ�У�Ũ������������ ��
��5���ȷֽ��з������·�Ӧ6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ��+ 2N2 ��+ 6SO2 ��+ 6SO3 ��+ 9H2O��������1mol Al2O3ʱת�Ƶ������ʵ���Ϊ mol��
��6������0.1mol�����ϡ��Һ����μ��뺬0.3mol Ba(OH)2��ϡ��Һ����Ӧ�������ӷ���ʽΪ: ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.01 mol/L���軯�����Ȼ�����Һ��100 mL��һ�������·�Ӧ��3KSCN +FeCl3![]() Fe��SCN��3 + 3KCl���ﵽƽ���������Һ����5g���й�������Һ����仯���Բ���������Ӱ��ƽ�����
Fe��SCN��3 + 3KCl���ﵽƽ���������Һ����5g���й�������Һ����仯���Բ���������Ӱ��ƽ�����
A���Ȼ��� B���Ȼ��� C�����軯�� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᱽ����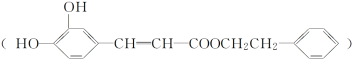 ��һ����Ȼ����ҩ���һ���������ܷ�������ת����
��һ����Ȼ����ҩ���һ���������ܷ�������ת����
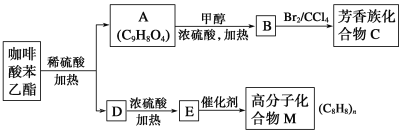
��ش��������⣺
��1��A�����еĹ�������_______________________________��
��2��E��M�ķ�Ӧ����Ϊ________��B��C�ķ�Ӧ����Ϊ__________��
��3���߷��ӻ�����M�Ľṹ��ʽ��_______________________________��
��4��д��A��B��Ӧ�Ļ�ѧ����ʽ��__________________________________��
��5��A��ͬ���칹���кܶ��֣�����ͬʱ��������������ͬ���칹����________�֡�
�ٱ�����ֻ������ȡ���� ���ܷ���������Ӧ
������̼��������Һ��Ӧ �������Ȼ�����Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡ����þ�����������У���Ũ���ᾧ��ˮ �ڼ���ʯ�� �ۼ����� �ܹ��� �����ڵ�⣬��ȷ������˳����
A���٢ڢۢܢ� B���ݢܢۢ٢� C���ڢܢۢ٢� D���ۢܢڢ٢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com