
【题目】浓度均为0.01 mol/L硫氰化钾与氯化铁溶液各100 mL在一定条件下反应:3KSCN +FeCl3![]() Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
A.氯化铁 B.氯化钾 C.硫氰化钾 D.氢氧化钠
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】将羧酸的碱金属盐电解可生成烃类化合物,例如
2CH3COOK+2H2O=CH3—CH3↑+2CO2↑+H2↑+2KOH
现充分电解CH2ClCOOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
A.CO2气体在阴极放出
B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体物质是KOH
D.混合液蒸干后得到的固体物质是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):


(1)Y的电子式为 ,构成C单质的元素在周期表中位于
(2)反应①的离子方程式为 反应②的离子方程式为
(3)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为: 静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某学生设计了一个实验以证明PbO中含有氧,反应方程式如下:
① PbO + C![]() Pb + CO (主要)
Pb + CO (主要)
② PbO + CO![]() Pb + CO2
Pb + CO2
③〔Cu (NH3 )2〕Ac + CO +NH3![]() 〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
试根据下图回答问题:

(1) 盛澄清石灰水的试管开始一段时间可能没有现象,其原因是 。
(2) 烧杯中醋酸二氨合铜 (〔Cu (NH3 )2〕Ac ) 的作用为 。
(3) 实验后的醋酸二氨合铜经适当处理又可再生,适宜于再生的生产条件是 。(说明;不能加药品仅从生产条件考虑,以节约成本)
Ⅱ、图像分析是化学研究的一种重要的手段。某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出)。请回答:
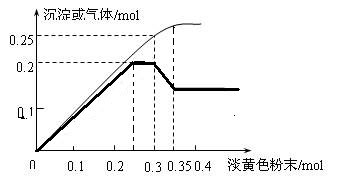
(1)根据图像所示,推测溶液中肯定有_____________离子。(写化学式)
(2)请写出曲线中过氧化钠物质的量在0.3~0.35mol时,粗的曲线出现下滑的现象,请用两个离子反应方程式解释该过程___________________,_________________.
(3)溶液中离子的物质的量之比为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海藻灰中可以提取碘的主要反应为:2 I-+Cl2=2 Cl-+I2,下列说法正确的是)( )
A.该反应属于置换反应 B.I-具有氧化性
C.1mol氯气转移了1mol电子 D.Cl2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,可以大量共存的离子组是( )
A.某无色溶液中:Na+、Cu2+、Cl-、MnO4-
B.含有大量Fe3+的溶液中:Na+、SO42-、K+、SCN- -
C.含有大量NH4+的溶液中:Ba2+、 K+、Cl-、OH-
D.在pH=1的溶液中:K+、Fe3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 ;
(2)浓硫酸的作用是: ;
(3)饱和碳酸钠溶液的主要作用是___ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com