
【题目】从海水中提取金属镁的生产步骤有:①浓缩结晶 ②加盐酸 ③加熟石灰④过滤 ⑤熔融电解,正确的生产顺序是
A.①②③④⑤ B.②④③①⑤ C.⑤④③①② D.③④②①⑤
科目:高中化学 来源: 题型:
【题目】某溶液仅含如表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1 mol。
阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
阴离子 | OH- CO |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变。
请推断:
(1)原溶液中含有的阳离子是________; 含有的阴离子是________________。
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为___________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)___________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:(用离子方程式表示)________________。
溶液中所含离子浓度由大到小的顺序为________________。
(4)YX4M的电子式为___________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为
____________________。
(5)X、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为_______________________。
(6)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
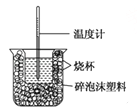
(1)图示装置有两处重要组成部分未画出,它们是 、 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)若操作时分几次注入反应液,求得的反应热数值 (填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用 次。
(5)量取0.5mol/L的盐酸和0.55mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c = 4.18 J/g℃。请列式计算中和热:△H= kJ/mol(不用化简)。
(6)已知:HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) △H1= a kJ/mol
HCl(aq)+NH3H2O(aq)===NH4Cl(aq)+H2O(l) △H2= b kJ/mol
则NH3H2O(aq)![]() NH4+(aq)+ OH-(aq) △H3= ________ kJ/mol(用a、b表示)
NH4+(aq)+ OH-(aq) △H3= ________ kJ/mol(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):


(1)Y的电子式为 ,构成C单质的元素在周期表中位于
(2)反应①的离子方程式为 反应②的离子方程式为
(3)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为: 静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com