
【题目】在下列粒子半径的比较中,正确的是
A. Na+ >Na B. Cl->Cl C. Ca2+ >Cl- D. Mg>Na
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂。
(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______________.
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是_____(填字母)
A.最高正化合价:P>C
B.同温同浓度的两溶液的酸性:H3PO4>H2CO3
C.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去);
![]()
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热烈4.76kJ,则该反应的热化学方程式为_______________________________。
②已知M溶液中硫元素的主要存在形式为S2O32—,则反应Ⅲ中生成S2O32—的离子方程式为_______________.
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图像分析可知,a点时M溶液中除S2O32—外,还有______________(填含硫微粒的离子符号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
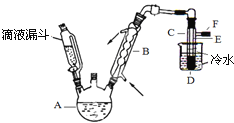
【题目】下图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置。反应需要加热,图中省去了加热装置。乙醇、溴乙烷、溴的有关性状参数见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
水溶性 | 易溶 | 难溶 | 微溶 |
(1)加热A中三种反应物的混合物时,发生反应的化学方程式为: 。
(2)若选用较浓的硫酸作为反应物,得到的产品则会呈棕黄色,这说明反应过程中有 生成。为去除颜色,最好选择下列的 溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.碘化亚铁 D.亚硫酸钠
产品选择上述溶液洗涤后,还需再用蒸馏水洗涤一次。洗涤液与产品分离的方法是 (填方法名称)。
(3)装置中,B和D两部分的作用分别是:B ;D 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是
A.SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同,但化学键种类不同
C.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C结构如下:
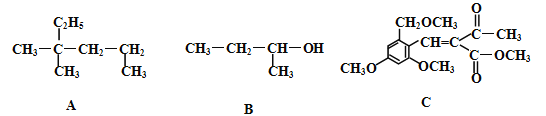
(1)A分子的主链上有 个碳原子 ;若A是某单烯烃与H2发生加成反应后得到的产物,符合此条件的单烯烃有 种。
(2)B在常温下呈 态;B的系统命名法名称是 。
(3)C的分子式是 ,向C中滴入溴水时,1molC能与 molBr2发生加成。
(4)关于A、B、C三种物质的下列说法中不正确的是 。
a.都能发生氧化反应
b.都能发生消去反应
c.都能发生取代反应
d.都能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的生产步骤有:①浓缩结晶 ②加盐酸 ③加熟石灰④过滤 ⑤熔融电解,正确的生产顺序是
A.①②③④⑤ B.②④③①⑤ C.⑤④③①② D.③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下6种说法:①氯水、氨水、水玻璃、水银都是混合物;②明矾、冰醋酸、石膏都是电解质;③氯酸、烧碱、纯碱依次分别为酸、碱、盐;④11H+、21H+、31H+互为同位素;⑤胶体带电是电泳的前提条件;⑥生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品。其中不正确的是
A.①⑤ B.①④⑤⑥ C.②③④ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。

请回答下列问题:
(1)图中A、C分别表示________、________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式: ; 。
(4)在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2进行可逆反应: 2SO2(g)+O2(g)![]() 2SO3(g),2min后测得O2的物质的量为1.6mol,则:若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
2SO3(g),2min后测得O2的物质的量为1.6mol,则:若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
(5)已知单质硫的燃烧热为296 kJ·mol-1,写出由S(s)生成3 mol SO3(g)的热化学方程式(要求写出简单计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com