
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。

请回答下列问题:
(1)图中A、C分别表示________、________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式: ; 。
(4)在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2进行可逆反应: 2SO2(g)+O2(g)![]() 2SO3(g),2min后测得O2的物质的量为1.6mol,则:若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
2SO3(g),2min后测得O2的物质的量为1.6mol,则:若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
(5)已知单质硫的燃烧热为296 kJ·mol-1,写出由S(s)生成3 mol SO3(g)的热化学方程式(要求写出简单计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
【答案】31、(1)反应物总能量;生成物总能量;(2)-198;(3)SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5;
(4)0.1mol/(L·min); 0.2mol/(L·min)
(5)3S(s)+9/2O2(g)=3SO3(g)△H= -1185 KJmol-1。
【解析】
试题分析:(1)根据图示可知,图中A、C分别表示反应物总能量、生成物总能量;
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1,图是2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化图,所以图中ΔH=-99×2=-198 kJ·mol-1;
2SO3(g)反应过程的能量变化图,所以图中ΔH=-99×2=-198 kJ·mol-1;
(3)V2O5氧化SO2时,自身被还原为四价钒化合物,化学方程式为SO2+V2O5=SO3+2VO2 ;四价钒化合物被氧气氧化生成五氧化二钒,化学方程式为4VO2+O2=2V2O5;
(4)2min后测得O2的物质的量为1.6mol,则用O2的浓度变化来表示该反应的反应速率为V(O2)= (2mol-1.6mol)÷(2L×2min)= 0.1mol/(L·min);根据化学反应速率之比等于化学计量数之比,则若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=0.2mol/(L·min)。
(5)①S(s)+O2(g)=SO2(g)△H1=-296 KJmol-1,
②SO2(g)+1/2O2(g)SO3(g)△H2=-99 KJmol-1 ;依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol;计算由S(s)生成3molSO3(g)③×3得到:
3S(s)+9/2O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 KJmol-1。


科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
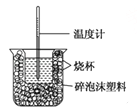
(1)图示装置有两处重要组成部分未画出,它们是 、 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)若操作时分几次注入反应液,求得的反应热数值 (填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用 次。
(5)量取0.5mol/L的盐酸和0.55mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c = 4.18 J/g℃。请列式计算中和热:△H= kJ/mol(不用化简)。
(6)已知:HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) △H1= a kJ/mol
HCl(aq)+NH3H2O(aq)===NH4Cl(aq)+H2O(l) △H2= b kJ/mol
则NH3H2O(aq)![]() NH4+(aq)+ OH-(aq) △H3= ________ kJ/mol(用a、b表示)
NH4+(aq)+ OH-(aq) △H3= ________ kJ/mol(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
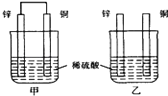
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 甲、乙溶液均变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将羧酸的碱金属盐电解可生成烃类化合物,例如
2CH3COOK+2H2O=CH3—CH3↑+2CO2↑+H2↑+2KOH
现充分电解CH2ClCOOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
A.CO2气体在阴极放出
B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体物质是KOH
D.混合液蒸干后得到的固体物质是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色;
②苯中碳碳键的键长均相等;
③苯能在一定条件下跟H2加成生成环己烷;
④经实验测得邻二甲苯(![]() )仅一种结构;
)仅一种结构;
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不能因化学变化而使溴水褪色。
A. ③④⑤ B. ①③④ . C. ①②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):


(1)Y的电子式为 ,构成C单质的元素在周期表中位于
(2)反应①的离子方程式为 反应②的离子方程式为
(3)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为: 静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作___________剂。
(2)自然界Cr主要以+3价和+6价(Cr2O7-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出离子方程式:__________________
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
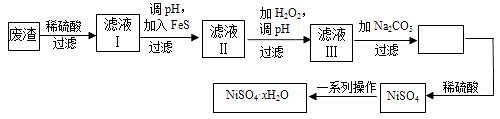
![]() ①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3 g晶体加热至完全失去结晶水,剩余固体15.5 g,计算x的值等于 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com