
����Ŀ�������ᱽ����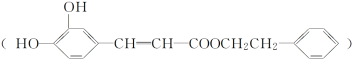 ��һ����Ȼ����ҩ���һ���������ܷ�������ת����
��һ����Ȼ����ҩ���һ���������ܷ�������ת����
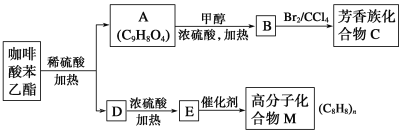
��ش��������⣺
��1��A�����еĹ�������_______________________________��
��2��E��M�ķ�Ӧ����Ϊ________��B��C�ķ�Ӧ����Ϊ__________��
��3���߷��ӻ�����M�Ľṹ��ʽ��_______________________________��
��4��д��A��B��Ӧ�Ļ�ѧ����ʽ��__________________________________��
��5��A��ͬ���칹���кܶ��֣�����ͬʱ��������������ͬ���칹����________�֡�
�ٱ�����ֻ������ȡ���� ���ܷ���������Ӧ
������̼��������Һ��Ӧ �������Ȼ�����Һ������ɫ��Ӧ
���𰸡���1���ǻ�(����ǻ�)���Ȼ���̼̼˫����2�֣� ��2�� �Ӿ۷�Ӧ �ӳɷ�Ӧ��ÿ��1�֣���2�֣�
��3��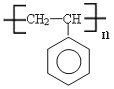 ��4��
��4��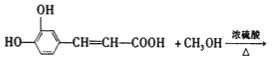
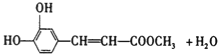 ��5�� 3��2�֣�
��5�� 3��2�֣�
��������
������������ݿ����ᱽ�����Ľṹ��ʽ�жϣ���ϡ���ᡢ���������¿����ᱽ��������ˮ�ⷴӦ�����ɵ�D�ķ����к���8��Cԭ�ӣ�����D�DZ��Ҵ������Ҵ���Ũ���������������������·�����ȥ��Ӧ������E�DZ���ϩ������ϩ�����Ӿ۷�Ӧ�����ɾ۱���ϩ���ṹ��ʽΪ ��A�Ľṹ��ʽΪ
��A�Ľṹ��ʽΪ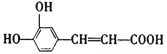 ����״�����������Ӧ����B����B�Ľṹ��ʽΪ
����״�����������Ӧ����B����B�Ľṹ��ʽΪ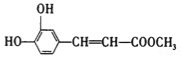 ��B�к���̼̼˫��������ˮ�����ӳɷ�Ӧ����C��
��B�к���̼̼˫��������ˮ�����ӳɷ�Ӧ����C��
��1������A�Ľṹ��ʽ��֪�����еĹ��������ǻ�(����ǻ�)���Ȼ���̼̼˫����
��2���������Ϸ�����֪E��M�ķ�Ӧ����Ϊ�Ӿ۷�Ӧ��B��C�ķ�Ӧ����Ϊ�ӳɷ�Ӧ��
��3���߷��ӻ�����M�Ľṹ��ʽ�� ��
��
��4��A��B��Ӧ�Ļ�ѧ����ʽΪ
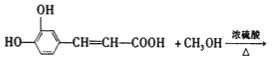
 ��
��
��5��A��ͬ���칹���к�������ȡ�������ֱ�λ���ڡ��䡢�Ե�λ�ã��ܷ���������Ӧ��˵�������к���ȩ��������̼��������Һ��Ӧ��˵�������к����Ȼ��������Ȼ�����Һ������ɫ��Ӧ��˵�������к��з��ǻ���������ǻ��⣬����ȡ����Ϊ-CH(CHO)COOH������ȡ�����̶�������������ֻ���ڡ��䡢�Ե�3��ͬ���칹�塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϡ��Һ�У��������кͷ�Ӧ����1molˮʱ�ķ�Ӧ�Ƚ����к��ȣ���������ͼװ�ý����к��ȵIJⶨ����ش��������⣺
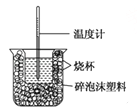
��1��ͼʾװ����������Ҫ��ɲ���δ������������ �� ��
��2���ձ�����������ĭ���ϵ������� ��
��3��������ʱ�ּ���ע�뷴ӦҺ����õķ�Ӧ����ֵ ���ƫ��ƫС������Ӱ�족����
��4����һ���������к��Ȳⶨʵ�飬�¶ȼ���ʹ�� �Ρ�
��5����ȡ0.5mol/L�������0.55mol/L��NaOH��Һ��50 mL����ʵ�飬��������NaOH��Һ��ʼƽ���¶�Ϊt1������Ϸ�Ӧ������¶�Ϊt2��������Һ�ܶȾ�Ϊ1 g/mL��������Һ�ı�����c = 4.18 J/g�档����ʽ�����к��ȣ���H= kJ/mol�����û���
��6����֪��HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l�� ��H1= a kJ/mol
HCl(aq)+NH3H2O(aq)===NH4Cl(aq)+H2O(l�� ��H2= b kJ/mol
��NH3H2O(aq)![]() NH4+(aq��+ OH-(aq�� ��H3= ________ kJ/mol����a��b��ʾ��
NH4+(aq��+ OH-(aq�� ��H3= ________ kJ/mol����a��b��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����ѧ��ѧ�������ʣ� X��Y��Z��M��N��W��H��K�dz��������X��B��C�Ļ��ϲ������֮��������ת����ϵ����Ӧ��Ͳ����е�H2O����ȥ����


��1��Y�ĵ���ʽΪ ������C���ʵ�Ԫ�������ڱ���λ��
��2����Ӧ�������ӷ���ʽΪ ��Ӧ�������ӷ���ʽΪ
��3��ij������B��Ư�ۡ�
��д����Ư�۵Ļ�ѧ����ʽ
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ijС�����������ʵ�飺��ȡƯ��2.0g����ĥ���ܽ⣬������250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ��������������ʱ���������ӷ���ʽΪ�� ���á�����ȫ��Ӧ����0.1mol��L-1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷ�����������Ϊ ��������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����𱽷���Һ����ϩ�ͼױ�����ѡ�õ�����Լ���
A����ˮ B��FeCl3��Һ
C������Cu(OH)2����Һ D������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�����п�����ȡ�����Ҫ��ӦΪ��2 I-+Cl2=2 Cl-+I2������˵����ȷ�������� ��
A���÷�Ӧ�����û���Ӧ B��I-����������
C��1mol����ת����1mol���� D��Cl2�ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cu��Fe2O3�Ļ�����м���100mL 1molL��1�����ᣬǡ��ʹ�������ȫ�ܽ⣬������Һ�в���Fe3+�����ù�����CO�ڸ����»�ԭ��ͬ������ԭ����������ٵ�����Ϊ
A��3.2 g B�� 2.4 g C��1.6 g D��0.8 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£����Դ������������������ ��
A��ij��ɫ��Һ�У�Na+��Cu2+��Cl-��MnO4-
B�����д���Fe3+����Һ�У�Na+��SO42����K+��SCN�� -
C�����д���NH4+����Һ�У�Ba2+�� K+��Cl-��OH-
D����pH=1����Һ�У�K+��Fe3+��Cl-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���桢�����ѡ����䲻����ѧ�γ����Ľ���Ԫ�أ����ڹ�ҵ������������Ҫ���á�
��1����������(CeO2)��ƽ�������ʾ����������ҪӦ�á�CeO2��ϡ�����H2O2�������¿�����Ce3+��CeO2�ڸ÷�Ӧ����___________����
��2����Ȼ��Cr��Ҫ��+3�ۺ�+6����Cr2O7-�����ڡ�+6�۵�Cr������ϸ����ͻ�����������������ƽ��仹ԭΪ+3�۵ĸ���д�����ӷ���ʽ��__________________
��3���ѣ�Ti������Ϊ����ʮһ���͵Ľ���������ҵ����550��ʱ���������Ȼ��ѷ�Ӧ���Ƶ��ѣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4��NiSO4��xH2O��һ����ɫ������ˮ�ľ��壬�㷺���ڶ�������صȣ����ɵ�Ʒ���(�����⣬������ͭ��п������Ԫ��)Ϊԭ�ϻ�á������������£�
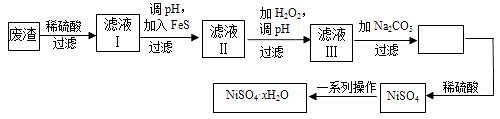
![]() ������Һ���м���FeS��Ϊ�˳�ȥCu2+��Zn2+�����ʣ���ȥCu2+�����ӷ���ʽΪ__________��
������Һ���м���FeS��Ϊ�˳�ȥCu2+��Zn2+�����ʣ���ȥCu2+�����ӷ���ʽΪ__________��
������Һ���ȼ�H2O2�ٵ�pH����pH��Ŀ���� ��
����Һ�����ʵ���Ҫ�ɷ���NiSO4����Na2CO3���˺��ټ�����ϡ�����ܽ�������NiSO4��������������Ŀ����____________��
��Ϊ�ⶨNiSO4��xH2O������x��ֵ����ȡ26��3 g�����������ȫʧȥ�ᾧˮ��ʣ�����15��5 g������x��ֵ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2+8NH3�T7N2+12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ������˵������ȷ���ǣ� ��
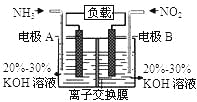
A. �������Ҳ�缫�������غ��������缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ��2NH3-6e-=N2+6H+
D. ����4.48L NO2����״���� ������ʱ��ת�Ƶ���Ϊ0.8mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com