
【题目】某药物中间体K的一种合成路线如下。

已知:RNH2+![]()
![]()
![]() +H2O
+H2O
![]() +
+![]()
![]()

![]()

(1)A→B的反应类型是____________,D中含有的官能团名称是________________。
(2)E的化学名称是________________,K的分子式是__________________________。
(3)F与足量NaOH溶液反应的化学方程式为_________________________________。
(4)J的结构简式为______________________。
(5)G的同分异构体中能同时满足下列条件的共有______种(不含立体异构):
①能与金属钠反应产生气体 ②既能发生银镜反应,又能发生水解反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是___________(写结构简式)。
(6)季戊四醇( )是重要的化工原料。设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)________________________。
)是重要的化工原料。设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)________________________。
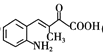
【答案】取代反应 醛基、氨基 丁酸 C11H9NO2 ![]()
 5
5 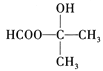
【解析】
(1)A分子式C7H8,是甲苯![]() ,甲苯与浓硫酸、浓硝酸共热发生取代反应,产生B为邻硝基甲苯
,甲苯与浓硫酸、浓硝酸共热发生取代反应,产生B为邻硝基甲苯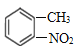 ,B与MnO2反应,甲基被氧化生成醛基,得到C:
,B与MnO2反应,甲基被氧化生成醛基,得到C:![]() ;C发生还原反应,得到D为
;C发生还原反应,得到D为![]() ,E分子式为C4H8O2,根据反应产生的F结构简式可知E为丁酸,结构简式为CH3CH2CH2COOH,与Br2在PBr3作用下发生取代反应产生F:
,E分子式为C4H8O2,根据反应产生的F结构简式可知E为丁酸,结构简式为CH3CH2CH2COOH,与Br2在PBr3作用下发生取代反应产生F:![]() ;F与NaOH溶液共热发生反应,然后酸化可得G:
;F与NaOH溶液共热发生反应,然后酸化可得G:![]() ;G与O2在催化剂作用下醇羟基被氧化变为羰基,反应产生H:
;G与O2在催化剂作用下醇羟基被氧化变为羰基,反应产生H:![]() ;H与D在NaOH存在并加热时反应产生J:
;H与D在NaOH存在并加热时反应产生J: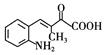 ,J在一定条件下发生消去反应产生K:
,J在一定条件下发生消去反应产生K: ,据此分析解答。
,据此分析解答。
(1)A是甲苯,甲苯与浓硫酸、浓硝酸共热发生取代反应,产生B为邻硝基甲苯 ,所以A→B的反应类型是取代反应;D的结构简式为
,所以A→B的反应类型是取代反应;D的结构简式为![]() ,可知D中含有的官能团名称是醛基、氨基;
,可知D中含有的官能团名称是醛基、氨基;
(2) E结构简式为CH3CH2CH2COOH, E的化学名称是丁酸,K的结构简式为 ,根据结构简式可得出K的分子式是C11H9NO2;
,根据结构简式可得出K的分子式是C11H9NO2;
(3)F是![]() ,与足量NaOH溶液反应,羧基发生中和反应,Br原子发生取代反应,Br原子变为—OH,同时产生HBr,HBr与NaOH发生中和反应,所以1molF可以与2molNaOH反应,该反应的化学方程式为
,与足量NaOH溶液反应,羧基发生中和反应,Br原子发生取代反应,Br原子变为—OH,同时产生HBr,HBr与NaOH发生中和反应,所以1molF可以与2molNaOH反应,该反应的化学方程式为![]() ;
;
(4)根据上述推断可知J的结构简式为 ;
;
(5)G结构简式为![]() ,G的同分异构体满足条件:①能与金属钠反应产生气体②既能发生银镜反应,又能发生水解反应,说明含有酯基、醛基,则说明该同分异构体中含—OH及甲酸形成的酯基,则其可能的同分异构体为HCOOCH2CH2CH2OH、
,G的同分异构体满足条件:①能与金属钠反应产生气体②既能发生银镜反应,又能发生水解反应,说明含有酯基、醛基,则说明该同分异构体中含—OH及甲酸形成的酯基,则其可能的同分异构体为HCOOCH2CH2CH2OH、
![]() 、
、![]() 、
、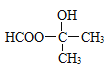 、
、![]() ,共5种不同的结构;其中核磁共振氢谱显示为3组峰,说明分子中含有3种不同的H原子,峰面积比为6:1:1的是
,共5种不同的结构;其中核磁共振氢谱显示为3组峰,说明分子中含有3种不同的H原子,峰面积比为6:1:1的是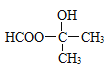 ;
;
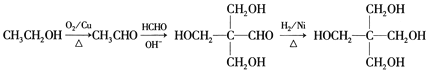
(6)甲醇催化氧化产生甲醛HCHO,乙醇催化氧化产生乙醛CH3CHO,然后使乙醛与甲醛在碱性条件下发生醛与醛的加成反应产生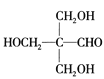 ,该物质与H2在镍作催化剂时发生加成反应产生季戊四醇,结构简式为
,该物质与H2在镍作催化剂时发生加成反应产生季戊四醇,结构简式为 。故该合成路线为:
。故该合成路线为:
 。
。


科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列关于有机物X的说法中正确的是
。下列关于有机物X的说法中正确的是
A. X的含氧官能团是酯基和羟基
B. 有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含苯环,则Y的结构有8种
C. 1molX与足量Na完全反应生成11.2LH2
D. X的分子式为C7H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷是生物体中不可缺少的元素,它们能形成多种化合物。

(1)基态氮原子的价层电子排布图为___________。
(2)NF3的键角小于NH3的原因是__________________。
(3)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构。
①该化合物的分子式为______________,分子中硫原子的杂化轨道类型为____________________。
②磷的第一电离能大于硫的原因是________________________。
(4)PCl5中P—Cl键长有198pm和206 pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,阴离子的化学式为_________________。
(5)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
(6)某直链多磷酸钠的阴离子呈如图3所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的CO2和O2,其分子数目之比为_____,原子数目之比为___,氧原子数目之比为____;质量相同的CO2和O2,其物质的量之比为____。
(2)4.8gO2和0.2 mol CO2,它们的物质的量之比是____,质量之比是____,在同温同压下的体积之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法正确的是( )
A.医用消毒酒精的浓度为95%
B.淀粉遇碘元素显蓝色
C.糖类、油脂、蛋白质都是高分子化合物
D.蛋白质水解的最终产物为氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下进行反应:2A(s)+B(g)![]() 3C(g)+4D(g),分别测得了如下反应速率数据,其中反应速率最快的是
3C(g)+4D(g),分别测得了如下反应速率数据,其中反应速率最快的是
A. v(A)=0.7 mol·L-1·s-1 B. v(B)=0.3 mol·L-1·s-1
C. v(C)=0.8 mol·L-1·s-1 D. v(D)=1.0 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ②mg该硫原子的物质的量为
②mg该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com