
【题目】某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是______,生成物是_______,化学方程式为_____________________________;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为______________,若不能,则其原因为________________________________________________________;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了___________状态。
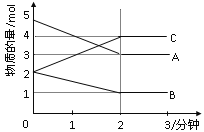
【答案】A B 2A+B2C 不能 无体积,无法求出浓度变化值 平衡
【解析】
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,则该反应的反应物是A、B,生成物为C,图象中物质的量的变化之比,等于化学方程式计量数之比,计算得到反应物和生成物变化量之比=n(A):n(B):n(C)=(5mol-3mol):(2mol-1mol):(4mol-2mol)=2:1:2,反应为可逆反应,反应的化学方程式:2A+B2C;随反应进行进行2min后A、B、C物质的量不变,说明反应达到平衡状态,正逆反应速率相同,反应是可逆反应;反应开始至2分钟时,可以求出C的变化量,但是题目中没有给定密闭容器的体积,无法求出C物质的变化的浓度,就不能计算出C的反应速率;
故答案为:A、B;2A+B2C;不能;无体积,无法求出浓度变化值;平衡。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】均三甲苯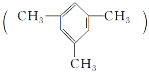 是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
(1)均三甲苯属于苯的同系物,选用一种试剂区别苯和均三甲苯:________________。
(2)均三甲苯分子中的一个H原子被Cl原子取代,所得产物有________种。
(3)下列属于苯的同系物的是________(填字母)。
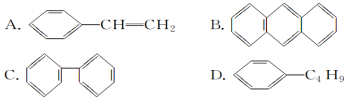
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是________(填字母)。
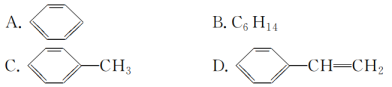
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
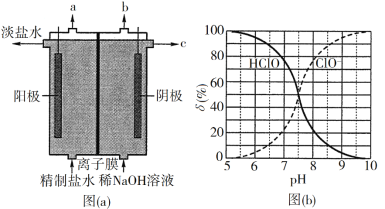
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=![]() ,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____mol;产生“气泡”的化学方程式为____________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____kg(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①(![]() +HNO3
+HNO3![]()
![]() +H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
+H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
目的 | 分液 | 配制混酸 | 水浴加热 | 蒸馏提纯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 molL1 的AgNO3溶液,乙池为1 molL1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是
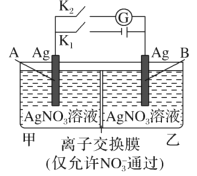
A.实验开始先断开K1,闭合K2,此时![]() 向B电极移动
向B电极移动
B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+ NaHCO3↓。完成下列填空:
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是_____,第二周期原子半径由大到小的是______。
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是______,该分子为_____( 选填“极性”、“非极性”)分子。
(3)写出上述元素中有三个未成对电子的原子核外电子排布式_____,下列关于该元素和氧元素之间非金属性大小判断依据正确的是____(填编号)
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围______个NH3通过氢键相结合。
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南京青奥会吉祥物为“砳砳”,一种“砳砳”的外用材料是纯羊毛线,内充物为涤纶(结构简式为![]() ,下列有关说法不正确的是( )
,下列有关说法不正确的是( )
A.可用灼烧的方法区别羊毛和涤纶
B.合成涤纶的单体之一是HOCH2CH2OH
C.涤纶属于天然高分子化合物
D.羊毛和涤纶所含元素不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+![]() +9H2,
+9H2,![]() 的结构如图所示:
的结构如图所示: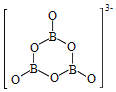 ;在该反应中,B原子的杂化轨道类型由______变为______。
;在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
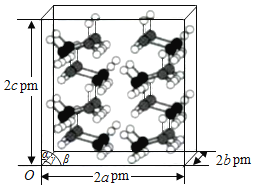
氨硼烷晶体的密度ρ=___________g·cm3(列出计算式,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以确保化学实验的绿色化。
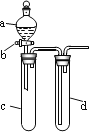
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL的浓硝酸。反应一段时间后,再由a向c中加2 mL蒸馏水,c中的实验现象有什么变化___________。
方案 | 甲 | 乙 | 丙 |
反应物 | Cu、浓HNO3 | Cu、稀HNO3 | Cu、O2、稀HNO3 |
(3)如表所示是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com