
【题目】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
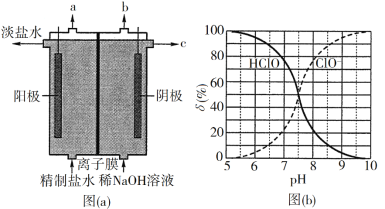
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=![]() ,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____mol;产生“气泡”的化学方程式为____________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____kg(保留整数)。
【答案】Na+ a 10-7.5 2Cl2+HgO=HgCl2+Cl2O 1.25 NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O ClO-+Cl-+2H+=Cl2↑+ H2O 203
【解析】
(1)电解饱和食盐水,阳极产生氯气,阳离子移向阴极室;
(2)由图pH=7.5时,c(HClO)=c(ClO-),HClO的Ka=![]() =c(H+);
=c(H+);
(3)Cl2歧化为Cl2O和Cl-;
(4)根据5ClO2-+4H+=4ClO2+Cl-+2H2O,计算每生成1molClO2,消耗的NaClO2;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳;
(5)“84”中的NaClO、NaCl和酸性清洁剂混合后发生归中反应;根据NaOH质量守恒计算;
(1)电解饱和食盐水,反应的化学方程式为2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,阳极氯离子失电子发生氧化反应生成氯气,氯气从a口逸出,阴极氢离子得到电子发生还原反应生成氢气,产生OH-与通过离子膜的Na+在阴极室形成NaOH,故答案为:Na+;a;
2NaOH+Cl2↑+H2↑,阳极氯离子失电子发生氧化反应生成氯气,氯气从a口逸出,阴极氢离子得到电子发生还原反应生成氢气,产生OH-与通过离子膜的Na+在阴极室形成NaOH,故答案为:Na+;a;
(2)由图pH=7.5时,c(HClO)=c(ClO-),HClO的Ka=![]() =c(H+)=10-7.5;故答案为:10-7.5;
=c(H+)=10-7.5;故答案为:10-7.5;
(3)Cl2歧化为Cl2O和Cl-,HgO和氯气反应的方程式为:2Cl2+HgO=HgCl2+Cl2O,故答案为:2Cl2+HgO=HgCl2+Cl2O;
(4)5ClO2-+4H+=4ClO2+Cl-+2H2O,每生成1molClO2,消耗NaClO2为![]() =1.25mol;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳,方程式为:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑,故答案为:1.25mol;NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑;
=1.25mol;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳,方程式为:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑,故答案为:1.25mol;NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑;
(5)“84”中的NaClO、NaCl和酸性清洁剂混合后发生归中反应,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;设氯气为xkg,则消耗的NaOH为![]() kg,原氢氧化钠质量为
kg,原氢氧化钠质量为![]() +1000Kg×0.01,由NaOH质量守恒:原溶液为1000Kg-x,则
+1000Kg×0.01,由NaOH质量守恒:原溶液为1000Kg-x,则![]() Kg+1000Kg×0. 01=(1000Kg-x)×0.3,解得x=203Kg;故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;203。
Kg+1000Kg×0. 01=(1000Kg-x)×0.3,解得x=203Kg;故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;203。


科目:高中化学 来源: 题型:
【题目】(1)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式_______
(2)某炔烃和氢气充分加成生成2,5﹣二甲基己烷,该炔烃的结构简式是_______
(3)某芳香烃结构为![]() 。它一氯代物有_______种。
。它一氯代物有_______种。
(4)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_______。
(5) 分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和氨水反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是
A.新制饱和氯水使红玫瑰变力白玫瑰,说明含有Cl2
B.加入石蕊溶液,溶液变红,说明该溶液不含HC1O
C.光照新制氯水有气泡逸出,该气体是氧气
D.向氯水中KHCO3粉末有气泡产生,说明绿水中含有HC1O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高该反应平衡转化率的方法有_________、_________。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4![]() C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×![]() ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_____ r1。
②对于处于初期阶段的该反应,下列说法正确的是_________。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
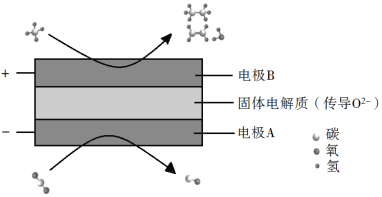
①阴极上的反应式为_________。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
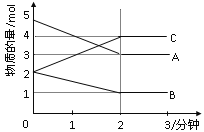
【题目】某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是______,生成物是_______,化学方程式为_____________________________;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为______________,若不能,则其原因为________________________________________________________;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了___________状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
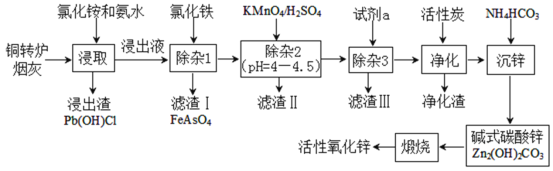
己知:活性炭净化主要是除去有机杂质。
(1)写出氯化铵的电子式___,“净化”过程属于___(填“物理”、“化学”)变化。
(2)在反应温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为___mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
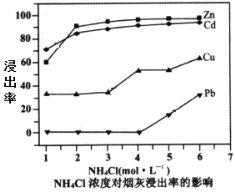
(3)滴加KMnO4溶液有MnO2生成,目的是除___元素,除杂3是置换除杂过程,则试剂a是___,“滤渣Ⅲ”的主要成分为___(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式___,此过程中可以循环利用的副产品是___。
(5)取mg活性氧化锌样品配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com