
H2C2O4��2H2O��ŨH2SO4�Ĵ������¿��Ʊ�CO��������ͨ�����ȵ�Fe2O3���У�������ʵ�飮���˷��Ʊ���CO�к����������壬�����ȥ����������װ�ã�
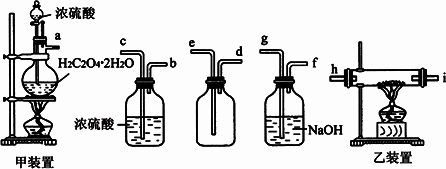
(1)д����װ���з����ķ�Ӧ�Ļ�ѧ����ʽ��________��
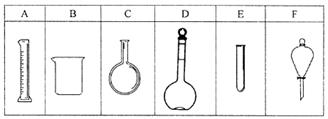
(2)��a��h��ʾ����˳��װ��������ȷ��
a��________��________��________��________��________��________��h��
(3)��ϴ��ƿ��������________��Ũ����ϴ��ƿ��������________��
(4)����i����β����Ӧ���õļ���Ч�ķ�����________��
(5)��A��F��ȷ��ʾ����ʵ��������Ⱥ�˳��________��
A����ȼ��װ�õľƾ��ƣ���Һ©��������Ũ����ĵ��٣�
B����ȼ��װ���еľƾ��ƣ�������������
C���������װ�õ������ԣ�
D�������ܿ�i����β������װ�����ã�
E����װ�ò����ڵ�Fe2O3���ʱ��Ϩ����װ���еľƾ��ƣ�
F���غü�װ���з�Һ©���Ŀ��غ���Ϩ���װ���еľƾ��ƣ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ����9���²⻯ѧ�Ծ��������棩 ���ͣ������
��16�֣���1����֪����N2��g��+O2��g��=2NO��g��; ��H=+180��5 kJ��mol-1
��4NH3��g��+5O2��g��= 4NO��g��+6H2O��g������H=-905 kJ��mol-1
��2H2��g��ʮO2��g��=2H2O��g������H=-483��6 kJ��mol-1
��N2��g��+3H2��g�� 2NH3��g���ġ�H=
��
2NH3��g���ġ�H=
��
��2����һ�������£���2mol N2��5mol H2�����һ��10 L���ܱ������У���Ӧ�����ͼ1��ʾ��
����5min�ڵ�ƽ����Ӧ����v��NH3���� ���ڴﵽƽ��ʱNH3���������Ϊ ��
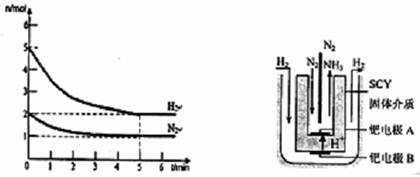
ͼ1 ͼ2 ��ⷨ�ϳɰ�װ��
��3����������ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶ�Ʒ��Ĥ���缫��ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ���װ����ͼ2�����ٵ缫A�Ϸ����ĵ缫��Ӧʽ�� ��
��4�����ᣨH2C2O4����һ����Ҫ�Ļ���ԭ�ϡ���֪������0.01 mol��L-l��H2C2O4��KHC2O4��K2C2O4 ��Һ��pH���±���ʾ��
|
|
H2C2O4 |
KHC2O4 |
K2C2O4 |
|
pH |
2.0 |
3.1 |
8.1 |
�������ӷ���ʽ��ʾKHC2O4�����Ե�ԭ��
��ȡһ������H2C2O4��2H2O��KHC2O4�Ļ�����ˮ�ܽ⣬���250 mL��Һ��ȡ���ݴ���Һ��25 mL�����һ����Һ���ȼ��뼸�η�̪��Һ���ٵμ�0.25 mol��L-l NaOH��Һ��20.00 mLʱ����Һ����ɫ��Ϊdz��ɫ����ڶ�����Һ�еμ�����3 mol��L-l H2SO4��Һ�ữ����0.10 mol��L-l KMnO4��Һ�ζ���������KMnO4��Һ16.00 mLʱ����Һ����ɫ��Ϊdz�Ϻ�ɫ����ش��������⣺
a.������ӷ���ʽ�� C2O42-+ MnO4-+ H+ �� CO2+ Mn2++ H2O��
b. ԭ�������H2C2O4��2H2O��KHC2O4�����ʵ���֮��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡģ���� ���ͣ������
 CH3OH��g������H
CH3OH��g������H 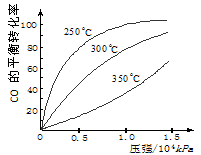
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
ij��ѧ��ȤС��������Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�졷ʵ��ʱ���֣�������Һ����������Һ��Ӧʱ����Һ��ɫ������졣Ϊ��̽���˷�Ӧ������С����ԭ��ͬѧ��������ʵ�顣
��1��0.10mol/L H2C2O4��Һ�����ƣ�
ʵ����������80mL 0.10mol/L H2C2O4 ��Һ����Ҫ��ȡ���ᾧ�壨H2C2O4��2H2O g����ȷ��0.1g����ʵ������Ҫ�õ��IJ����������˲���������ͷ�ιܡ���Ͳ��У� ��������ţ�
��2����Ӧ���ʱ仯��̽��
| 1���Թ� | 2���Թ� | |
| �����Լ� | 2mL0.10mol/L H2C2O4 ��Һ�� ����ϡ���ᣬ4mL0.010mol/L ��KMnO4��Һ | 2mL0.10mol/L H2C2O4 ��Һ���� ��ϡ���ᣬ4mL0.010mol/L�� KMnO4��Һ������MnSO4���塣 |
| ��ɫʱ�� | 31�� | 4�� |
��H2C2O4��Һ�����Ե�KMnO4��Һ��Ӧ�����ӷ���ʽΪ ��
�ڼ�ͬѧ�ܹ��ó����� ��
��3����һ�������£��ݻ�Ϊ100 L�ܱ������з�����Ӧ��CH4(g)+H20(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
 ��H>0����1��O molCH4��2��O mol H 20(g)ͨ����ܱ�������10 minʱ��O��1 mol CO���ɣ���10 min�ڸ÷�Ӧ��ƽ�����ʦ�(H2) ��
��H>0����1��O molCH4��2��O mol H 20(g)ͨ����ܱ�������10 minʱ��O��1 mol CO���ɣ���10 min�ڸ÷�Ӧ��ƽ�����ʦ�(H2) ��
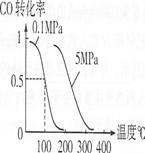
(4)��ѹǿΪO��1 MPa�����£��ݻ�ΪV Lij�ܱ�������amol CO��2amol H2�ڴ��������·�Ӧ���ɼ״���CO(g)+2H2(g)![]() CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
�ٸ÷�Ӧ��AH O(�<������>����=��)��
��100��ʱ�÷�Ӧ��ƽ�ⳣ��K (�ú�n��V�Ĵ���ʽ��ʾ)��
���������������������£�������a mol CO��2a mol H2���ﵽ��ƽ��ʱ��CO��ת���� (���������С�����䡱)��ƽ�ⳣ�� (���������С�����䡱)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com