
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和 NO2混和气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为_________L,NO2的体积为____________L;
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_________mol/l;
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3, 至少需要30%的双氧水____________g。
(1)5.8 5.4 (2)(aV·10-3 +0.5)/0.14 (3)57.8
【解析】
试题分析:(1)32.64g铜的物质的量是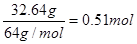
混合气的物质的量是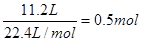
设混合气中NO和 NO2的物质的量分别是x和y
则x+y=0.5mol
根据电子的得失守恒可知3x+y=0.51mol×2
解得x=0.26mol、y=0.24mol
所以混合气中NO和 NO2在标准状况下的体积分别是
0.26mol×22.4L/mol=5.8L、0.24mol×22.4L/mol=5.4L
(2)当溶液中的Cu2+全部转化成沉淀时,溶液中的溶质是硝酸钠
根据钠原子守恒可知,硝酸钠的物质的量是0.1Vamol
因此根据氮原子守恒可知,原硝酸的物质的量是0.1Vamol+0.5mol
所以原硝酸溶液的浓度为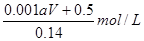
(3)混合气中NO的物质的量是0.26mol,在反应中失去0.26mol×3=0.78mol
NO2的物质的量是0.24mol,在反应中失去0.24mol×1=0.24mol
双氧水在反应中得到2个电子,根据电子的得失守恒可知
需要双氧水的物质的量是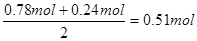
其质量是0.51mol×34g/mol=17.34g
因此至少需要30%的双氧水的质量是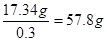
考点:考查金属铜和硝酸反应的有关计算
点评:该题也是化学计算中常见题型,重点是训练学生在化学计算中如何利用好各种守恒法,例如质量守恒、原子守恒、电荷守恒以及电子的得失守恒等。该题如果采用常规计算,则费时费力,且不易得分。该题难度较大。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| aV×10-3+0.5 |
| 0.14 |
| aV×10-3+0.5 |
| 0.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
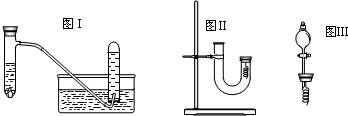
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源:2013届湖南省岳阳市一中高三第一次质量检测化学试卷(带解析) 题型:计算题
硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图像处理行业。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
(2)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L。其中NO的体积为_____________。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为 。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com