
【题目】将5mol·L-1 盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是:( )
A. 0.05mol/L B. 0.1mol/L C. 0.5mol/L D. 0.25mol/L
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程: 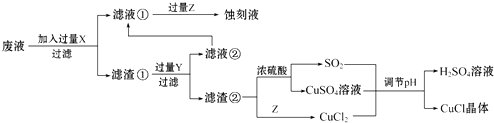
根据以上信息回答下列问题:
(1)生产过程中X的化学式为 .
(2)写出产生CuCl的化学方程式: .
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由 . 实际生产中SO2要适当过量,原因可能是(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为 , 当pH较大时CuCl产率变低原因是 . 调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是 .
(5)氯化亚铜的定量分析: ①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为(结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏低的是:( )
A. 定容时俯视容量瓶刻度线
B. 样品中含有少量Na2O杂质
C. 容量瓶使用前用NaOH溶液润洗
D. 在烧杯中溶解时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种可以作为药物的有机化合物.根据下列反应图式中各有机物的关系(所有无机物均已略去),回答下列问题:(提示: ![]() )
) 
(1)推测有机物A、B、C、E、F的结构简式、、、、 .
(2)写出下列反应的反应类型:C→D:;D→E: .
(3)写出下列反应的化学方程式: A→B;
A→C .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C﹣NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nCNa(1﹣x)MO2+NaxCn , 下列有关该电池的说法正确的是( ) 
A.电池放电时,溶液中钠离子向负极移动
B.电池充电时的阳极反应式为:nC+x Na+﹣xe﹣═NaxCn
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少
D.该电池负极的电极反应为:NaMO2﹣xe﹣═Na(1﹣x)MO2+xNa+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:

(1)铁元素位于元素周期表中第四周期__________族。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是氢原子的最外层电子“饱和缺一”。请写出LiH的电子式_____________,而且Li+的离子半径比H-_______(填“大”或“小”)。
(3)d的某化合物呈淡黄色,可与硫酸亚铁溶液反应生成红褐色沉绽和能使带火星的木条复燃的气体,d的该化合物中含有的化学键类型为__________________。
(4)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带______(填“正”或“负”)电荷。
(5)下列叙述正确的是______
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.氢化物的酸性:f弱于g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关原电池的工作原理中的下列说法中不正确的是( )
A.电池负极发生氧化反应
B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路)
D.电流方向是从负极流向正极(外电路)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com