
分析 (1)先计算出氧气减少的物质的量,然后利用方程式计算出2min内二氧化硫减少的物质的量;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算出用O2的浓度变化来表示该反应的反应速率.
解答 解:(1)反应2min后,测得O2的物质的量为0.8mol,则O2的物质的量变化为:1mol-0.8mol=0.2mol,根据反应2SO2+O2?2SO3可知,SO2减少的物质的量为:0.2mol×2=0.4mol,
故答案为:0.4mol;
(2)用O2的浓度变化来表示该反应的反应速率为:v(O2)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min).
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率的概念及表达式为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
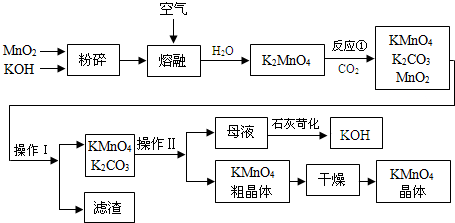

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
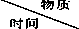 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com