
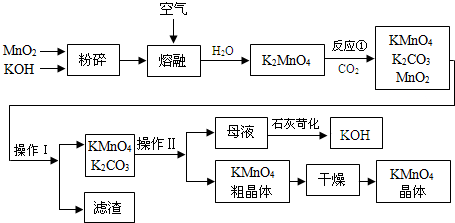

分析 MnO2与KOH在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,反应方程式为:3K2MnO4+2CO2═2KMnO4+2K2CO3+MnO2,过滤除去滤渣(MnO2),滤液中溶质为KMnO4、K2CO3,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH;
(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),二者发生氧化还原反应,溶液由无色变为紫色,根据反应物和生成物写出该反应的离子方程式;
(2)KMnO4稀溶液是一种常用的消毒剂,是因为高锰酸钾具有强氧化性;
(3)根据原子守恒及方程式计算1mol MnO2可制得KMnO4的物质的量;
(4)实验室用盐酸与石灰石制备二氧化碳,反应不需要加热,可以用启普发生器制备;
(5)利用KMnO4和K2CO3在溶解性上的差异性进行分离;
(6)在流程图中能参加且生成的物质可以循环利用.
解答 解:MnO2与KOH在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,反应方程式为:3K2MnO4+2CO2═2KMnO4+2K2CO3+MnO2,过滤除去滤渣(MnO2),滤液中溶质为KMnO4、K2CO3,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH;
(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),二者发生氧化还原反应,溶液由无色变为紫色,根据反应物和生成物写出该反应的离子方程式为2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5 Na++7H2O,
故答案为:2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5 Na++7H2O;
(2)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故答案为:AB;
(3)根据原子守恒得1molMnO2生成时1molK2MnO4,1molK2MnO4在反应3K2MnO4+2CO2═2KMnO4+2K2CO3+MnO2中生成$\frac{2}{3}$molKMnO4,所以理论上(不考虑物质循环与制备过程中的损失)1mol MnO2可制得$\frac{2}{3}$mol KMnO4,
故答案为:$\frac{2}{3}$;
(4)实验室用盐酸与石灰石制备二氧化碳,反应不需要加热,可以用启普发生器制备,离子反应方程式为CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:C;CaCO3+2H+=Ca2++H2O+CO2↑;
(5)KMnO4和K2CO3在水溶液中都易溶,但二者溶解性不同,所以利用KMnO4和K2CO3在溶解性上的差异性进行分离;采用浓缩结晶、趁热过滤得到KMnO4粗晶体,
故答案为:溶解性;浓缩结晶;
(6)根据流程分析可知:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用;
故答案为:MnO2;KOH.
点评 本题考查物质制备,为高考常考查方式,明确化学反应原理、物质分离提纯方法、物质性质是解本题关键,注意各个过程可能发生的反应及物质成分,注意(3)题理论上1mol MnO2不能制得1mol KMnO4,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 硫酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 碱石灰 | 硫酸钡 | NH3 |
| C | 纯碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
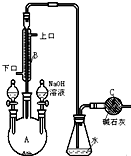 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题: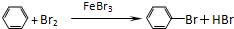 .
. +Br+→[
+Br+→[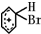 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com