
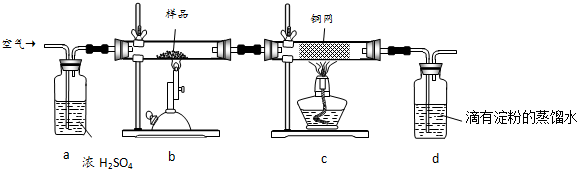

���� ��ʵ��ԭ���ǣ����ݻ�ͭ�����ȷֽ�����Ķ�����������IJⶨ��������������õ�ˮ���궨�������Ԫ���غ����ȷ����ͭ����������������䴿�ȣ�
��1����ȡ��ϸ�Ļ�ͭ����Ʒ1.840g����֪��ȷ��0.001g����Ҫѡ�������ƽ���������ı�������Լӿ컯ѧ��Ӧ���ʣ�
��2��Ũ������Խ�ˮ��ȥ�������Ը���ð�����ݵ����������ڿ������٣����ȵ�ͭ�����Գ�ȥ�����������
��3����������ȫ����������ʵ��ɰܵĹؼ���
��4����֪�����ķ�Ӧ��8CuFeS2+21O2$\frac{\underline{\;����\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2��I2+SO2+2H2O�TH2SO4+2HI���������ĵĵⵥ�ʵ����ʵ������CuFeS2�����ʵ������������ٸ�����Ʒ�������������������
��5����������͵��ʵ�֮�䷢��������ԭ��Ӧ���������ĵⵥ�ʵ�������ȷ�������������������ȷ����ͭ��Ĵ��ȣ�
��6��������̼�Ͷ�����������Ժ�����������Ӧ���ɰ�ɫ�����������ᱵ�ױ�����Ϊ���ᱵ��
��� �⣺��ʵ��ԭ���Ǹ��ݻ�ͭ�����ȷֽ�����Ķ�����������IJⶨ��������������õ�ˮ���궨�������Ԫ���غ����ȷ����ͭ����������������䴿�ȣ�
��1����ȡ��ϸ�Ļ�ͭ����Ʒ1.840g����֪��ȷ��0.001g��������Ʒ���õ�����Ϊ������ƽ������Ʒ��ϸ���ٷ�Ӧ�����������ı������Ŀ����ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ�
�ʴ�Ϊ��������ƽ������Ӵ������ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ�
��2��װ��a�е�Ũ����������տ����е�ˮ������ͬʱ����ð�������ݵ����������������ͨ���������ȵ�ͭ�����Գ�ȥ�����������
�ʴ�Ϊ��bd��e��
��3����ͭ�����ȷֽ����ɶ��������һϵ�в���ֽ���Ϻ���Ȼͨ����������Խ������Ķ�������ȫ���ų�ȥ��ʹ�����ȷ��
�ʴ�Ϊ��ʹ��Ӧ���ɵ�SO2ȫ������dװ���У�ʹ�����ȷ��
��4����֪�����ķ�Ӧ��8CuFeS2+21O2$\frac{\underline{\;����\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2��I2+SO2+2H2O�TH2SO4+2HI��
��0.05mol/L������Һ���еζ������ı���Һ20mL�������ĵĵⵥ�ʵ���Ϊ0.05mol/L��0.02L=0.0010mol��
���ݷ�Ӧ����ʽ�õ���2I2��2SO2��CuFeS2�����Ի�ͭ���������0.0010mol��$\frac{1}{2}$��184g/mol��10=0.92g��
�����䴿���ǣ�$\frac{0.92g}{1.84g}$��100%=50%��
�ʴ�Ϊ��50%��
��5������ͼ3װ���������ʵ��װ��d�������âۣ�ԭ����ǰ��ͨ��Ŀ�����Ҳ��ռ��һ����������������Ը���Һ�������ĸ߶ȿ���ȷ�����ɵ�������������Ԫ���غ���ȷ����ͭ��Ĵ��ȣ�
�ʴ�Ϊ���ڣ�
��6�������е�CO2��Ba��OH��2��Ӧ��������BaCO3����������BaSO3��������BaSO4�����Ե������Եij��������ȶ������������������Ӧ���ɵİ�ɫ���������࣬
�ʴ�Ϊ�������е�CO2��Ba��OH��2��Ӧ����BaCO3������BaSO3��������BaSO4��
���� ���⿼����̽����ͭ��Ĵ��ȣ��漰��ʵ��ԭ���ķ���Ӧ�á����ȼ��㡢ʵ�鷽�������۵�֪ʶ����Ŀ�Ѷ��еȣ�������ؿ���ѧ���ķ������������������Ӧ�û���֪ʶ��������


 �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��С�����˳��Ϊr��X����r��Y����r��Z����r��W�� | |
| B�� | X��Y��Z�����γ����ӻ���������γɹ��ۻ����� | |
| C�� | Z�ֱ�����X��Y��W�γɶ��ֻ����� | |
| D�� | �뵥��W�Ƚϣ�����Z�������뵥��X���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�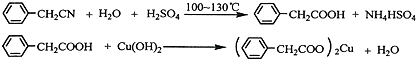
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
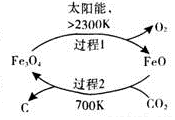 ������̼�Ļ��������ǻ��������о��ȵ㣮
������̼�Ļ��������ǻ��������о��ȵ㣮
| ʱ�䣨min�� Ũ�ȣ�mol•L-1�� | 0 | 10 | 20 | 30 | 40 | 50 |
| H2��g�� | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2��g�� | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2��g�� | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
 |  |  |  |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
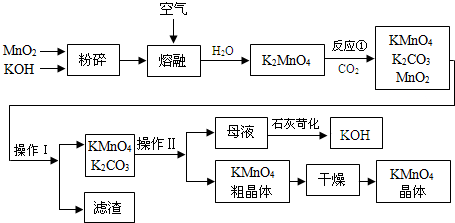

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com